 Nutrition
et production des carbonates chez les scléractiniaires
Nutrition
et production des carbonates chez les scléractiniaires
par Dietrich Schlichter - DATZ 10, 11, 12/1999 & 1/2000 suite de l'article paru dans la Gazette Marine n°75 - avril 2003
Au cours des dernières décennies des recherches concernant
le métabolisme physiologique les plus diverses ont été
effectuées sur de nombreuses espèces de corail de forme
et provenant des profondeurs les plus diverses. Le but était, avec
les données récoltées de manière expérimentale
de calculer quelle était la contribution primaire des zooxanthelles
en ce qui concerne le budget global du système de symbiose. On
peut faire des estimations simples, toutefois non précises, en
comparant l'énergie acquise par photosynthèse en une unité
de temps donnée avec l'énergie utilisée en même
temps par la respiration. Les deux valeurs peuvent être mesurées
dans des chambres de respiration. Le gain d'énergie est en rapport
avec l'oxygène délivré, qui résulte de la
synthèse des composés carbonés réduits (photosynthèse).
La consommation d'énergie par l'hôte et les algues est en
corrélation avec l'oxygène, qui est utilisé pour
l'oxydation des combinaisons organiques carbonées. Les deux processus
sont mesurables dans la chambre de respiration comme augmentation d'oxygène
et comme diminution d'oxygène. Des calculs plus précis sont
alors possibles de mesurer quelles quantités de photoassimilats
qui sont réellement fournis au tissu hôte par les algues,
en les déterminant avec la méthode du traceur 14C.
Dépendant de l'appartenance à l'espèce et de la profondeur,
des valeurs ont été évaluées qui démontrent
que les zooxanthelles contribuent entre 30 et 150 % aux besoins énergétiques
de leur hôte. Si cette valeur se situe au-dessus de 100 %, ceci
signifie que non seulement le besoin énergétique actuel
de l'hôte, est complètement couvert par les zooxanthelles,
mais que des substances nutritives pour la croissance et la reproduction
peuvent être mis à disposition. Les évaluations rendent
vraisemblables que de nombreuses espèces de coraux avec l'habitat
se situant à des profondeurs comprises entre 15 à 20 mètres
pourraient vivre exclusivement des photoassimilats de leurs zooxanthelles;
s'ils le font effectivement, n'est pas complètement éclairci
actuellement pour des raisons de méthode.
Outre n'est pas résolu, si les substances nutritives mises à
disposition par les zooxanthelles sont "de pleine valeur" ou
si les algues fournissent principalement des substances de moindre valeur,
qui seuls ne permettent pas une alimentation équilibrée
des hôtes. Outre les aspects quantitatifs du courant d'énergie
et de matière entre les algues et l'hôte, il faut pour cette
raison à l'avenir tenir compte de manière accrue des aspects
qualitatifs.
La nourriture particulaire ne semble pas être de valeur pour les
espèces de coraux symbiotiques, car elles ne peuvent pas vivre
longtemps sans zoxanthelles ; ceci signifie que les algues fournissent
probablement à leurs hôtes non seulement de "l'énergie",
mais aussi des substances vitales. Le phénomène décrit
peut toutefois ne constituer qu'un problème purement quantitatif
: peut-être les hôtes libérés expérimentalement
de leurs symbiontes meurent de faim, étant donné que l'offre
en nourriture particulaire n'est pas suffisante.
La lumière comme facteur limitant du milieu
Dans les récifs la fréquence des individus et des espèces
de scléractiniaires contenant des zooxanthelles diminue avec la
profondeur de l'eau. Dans la Mer Rouge septentrionale il y a 130 espèces
à 30 mètres de profondeur. Par 50 à 60 mètres
de profondeur il y en a encore plus de 40 et de 100, à 110 mètres
encore environ 8 espèces ; à partir de 110 mètres
une seule espèce a encore pu être observée (Leptoseris
fragilis) (Fricke & Schuhmacher 1983).
Le rayonnement devenant plus faible, ce à quoi on pense en premier
lieu, ne constitue pas l'unique facteur écologique efficace, qui
peut être rendu responsable de ce recul. La pression, les conditions
de courant, la composition du sous-sol, dont la tendance et l'offre en
nourriture particulaire se modifient également en fonction de la
profondeur. L'influence de la température sur la photosynthèse
est négligeable dans le golfe d'Akaba, car en-dessous et à
partir de 10 jusqu'à 1600 mètres la température est
constante allant de 21 à 22° C (Klinker et al. 1978). A partir
d'une certaine profondeur, plus exactement à partir d'une certaine
intensité de rayonnement - étant donné qu'il y a
aussi des emplacements avec une faible lumière en eau peu profonde
- l'énergie gagnée à partir de la photosynthèse
pour l'approvisionnement personnel des zooxanthelfes ne suffit plus, à
plus forte raison pour que les symbiontes peuvent délivrer les
photoassimilats excédentaires à leurs hôtes.
Si on prend pour base cette intensité lumineuse dans l'espace vital
pour des évaluations énergétiques, laquelle permet
juste une faible production excédentaire par les zooxanthelles,
le bilan suivant résulte dans le golfe d'Akaba au cours des mois
d'été: une espèce de corail située par 20
mètres de profondeur produit en onze heures plus d'énergie
qu'elle n'en nécessite pour la couverture du métabolisme
de base; ceci signifie qu'il reste de l'énergie pour la croissance
et la reproduction. Par 40 mètres de profondeur cette valeur se
réduit à 40 minutes, si bien que l'énergie manquante
doit être procurée par d'autres sources alimentaires.
La dépendance de l'hôte envers les zooxanthelles est différente
selon les espèces. Ceci explique probablement les différences
spectaculaires dans la distribution en fonction de la profondeur des espèces
les plus diverses (Kühlmann 1983). Certaines espèces du groupe
"cornes de cerf' n'apparaissent que jusqu'à 10 mètres
de profondeur, tandis que d'autres existent encore par des profondeurs
plus importantes ou ont seulement là leur distribution principale,
comme cela a été démontré pour Leptoseris
fragilis et Mycedium elephantotus.
Le record mondial de profondeur parmi les coraux durs zooxanthellate est
tenu par Leptoseris fragilis qui dans la Mer Rouge ont été
repéré par Hans Fricke et son sous-marin par 145 mètres
de profondeur. Des longueurs d'ondes courtes, c'est à dire des
zones spectrales bleues et violettes, sont prédominantes; la lumière
à ondes longues fait totalement défaut. Les coraux durs
sans algues symbiotiques se trouvent jusqu'à 6000 mètres
de profondeur.
Avec des chambres de respiration, avec l'aide desquelles la consommation
d'oxygène lors de la respiration et la production d'oxygène
lors de la photosynthèse ont pu être mesurés, la preuve
a été faite, que les zooxanthelles de Leptoseris fragilis
pratiquaient effectivement la photosynthèse et produisaient
durant les mois d'été une très faible surproduction
de composés riches en énergie qui profitent à l'hôte.
Le principe de la méthode de mesure a déjà été
décrit, Les mesures ont été effectuées dans
le biotope de L. fragilis avec le sous-marin, sur lequel les chambres
de mesures ont été installées à l'extérieur
et commandées de l'intérieur à l'aide d'un manipulateur.
Leptoseris approvisionne ses symbiontes avec la lumière
La plus étonnante adaptation des zooxanthelles aux faibles intensité
de rayonnement est que leur teneur en pigments (Chlorophylle a et chlorophylle
c2) par cellule d'algues est cinq à huit fois plus importante que
dans les zooxanthelles, qui proviennent des coraux d'eau peu profonde.
L'importante teneur en pigment rend possible l'absorption et l'utilisation
suivante d'intensités de rayonnement plus faibles.
Lors de l'adaptation à la lumière faible d'espèces
de coraux zooxanthellates on a toujours admis que pour l'adaptation seules
les zooxanthelles en étaient capables.
Une exception à cette règle a été apportée
par des examens ultrastructurels et photobiologiques chez L. fragilis
(Schlichter et al. 1985 ; Schlichter et Fricke 1991). Une production de
la symbiose de l'hôte complètement inconnue jusqu'à
présent a pu être découverte: l'hôte approvisionne
les symbiontes en lumière, améliorant ainsi la photosynthèse.
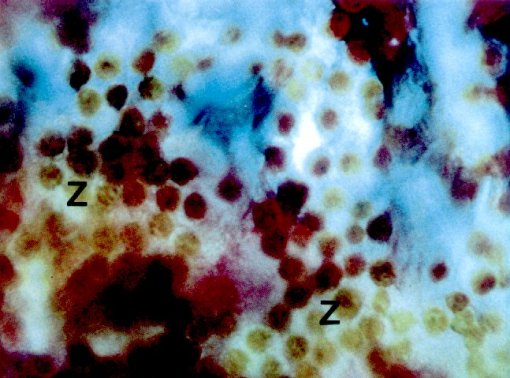
Dans le gastroderme de L. fragilis les zooxanthelles sont placées
en une couche sur les grains de pigments, qui appartiennent aux cellules
chromatophores de l'hôte. La couche unique des algues empêche
un ombrage mutuel. Les grains de pigments (0,5 à 1 micromètre
de diamètre) et les pigments (zoochromes) qui y sont localisés
améliorent l'approvisionnement des zooxanthelles par des artifices
physiques. Par réflexion et diffusion du rayonnement sur les grains
de pigments la probabilité se trouve augmentée, que le rayonnement
qui n'a pas été absorbé directement par les zooxanthelles,
peut encore être utilisé photosynthétiquement "dans
un deuxième élan".
En observant le tissu du corail avec un microscope à fluorescence,
les zooxanthelles présentent une fluorescence rougeâtre et
les pigments d'origine animale bleu clair. La fluorescence ne se produit
que si la préparation tissulaire est éclairée avec
de la lumière violette. Cette qualité de rayonnement se
produit dans le biotope de L. fragilis; elle ne peut cependant
qu'être mal utilisée par les zooxanthelles pour la photosynthèse.
Les pigments d'origine animale par contre absorbent le rayonnement violet
à ondes courtes et émettent un rayonnement bleu à
ondes plus longues, qui est photosynthétiquement très efficace.
Cette transformation de la lumière de courte vers longue ne crée
pas de lumière additionnelle, mais est seulement transformée
de "lumière inefficace" en "lumière efficace",
avec laquelle il est possible de réaliser la photosynthèse.
Ces mécanismes (réflexion, diffusion, transformation de
lumière) d'amélioration de l'offre en lumière pour
les zooxanthelles ne constituent pas un cas unique, comme l'on démontré
des analyses ultérieures. Les analyses de 78 espèces de
coraux durs d'eau peu profonde (jusqu'à 40 mètres) ont donné
que 13 autres espèces qui comme L. fragilis font partie
des Agariciidae, disposent également de cellules chromatophores
(Schlichter & al. 1994). Les espèces fluorescentes étaient
déjà connues dans le passé comme indicateur d'emplacement
en lumière faible; mais des espèces pionnières à
croissance rapide en font également partie. Les mécanismes
précédemment décrits apportent également des
avantages en eau peu profonde pour l'amélioration de l'exploitation
de la lumière: ceci permet de coloniser des emplacement à
faible lumière et l'ombrage par des espèces à croissance
rapide peut être mieux tolérée. Des coraux hébergeant
des chromatophores sont donc capables, contrairement aux espèces
sans systèmes de chromatophores, de pratiquer la photosynthèse
déjà plus tôt et de manière plus intensive
dans les heures matinales et proportionnellement plus longtemps le soir.
La contribution journalière photoautotrophe des zooxanthelles est
augmentée chez ces deux espèces.
Chez les pigments fluorescents des coraux il s'agit très vraisemblablement
de ptérine, dont la structure est actuellement en cours d'analyse.
Outre les pigments haussant la photosynthèse des espèces
de corail à faible lumière des pigments absorbant les UV
ont été trouvés chez espèces de coraux d'eau
de faible profondeur. Ils ont une fonction protectrice et contribuent
à l'auto coloration des coraux (Dunlap et al. 1986).
La présence exceptionnelle à grande profondeur de L.
fragilis permet de supposer, que cette espèce de corail dispose
d'assimilations particulières, qui permettent la photosynthèse
et ainsi la symbiose sous ces conditions lumineuses extrêmes. En
premier lieu on songe à des spécialisations des algues dans
le cas des photoadaptations, qui leurs permettent, même en présence
d'une intensité de rayonnement très faible de pratiquer
encore la photosynthèse. Dans le biotope de L. fragilis
seulement 0,5 à 1 % du rayonnement superficiel reste disponible
en été lorsque le soleil est au zénith. Mais non
seulement l'intensité du rayonnement se modifie avec la profondeur,
mais également la composition spectrale du rayonnement.
La formation du squelette calcaire des scléractiniaires est augmentée par les micro algues symbiotiques. *
Par formation asexuelle de nouveau polypes les colonies de coraux atteignent une taille impressionnante. Des diamètres de sept mètres et un âge de 500 années ne sont pas une exception. La plus grande partie des colonies atteint plutôt un diamètre de plusieurs décimètres et un âge de quelques dizaines d'années.
Production de carbonates et formation du squelette
 La croissance
du squelette est toujours précédée d'une multiplication
des tissus corporels produisant le calcaire. Les deux processus nécessitent
de l'énergie, qui provient de l'une des sources de nourriture évoquées
ci-dessus.
La croissance
du squelette est toujours précédée d'une multiplication
des tissus corporels produisant le calcaire. Les deux processus nécessitent
de l'énergie, qui provient de l'une des sources de nourriture évoquées
ci-dessus.
Les colonies de coraux poussent, par dépôt de couches de
carbonate de calcium faisant épaissir le squelette existant. L'augmentation
de la taille des colonies a lieu à la périphérie.
Les branches existantes sont prolongées par une croissance terminale
(linéaire) ou de nouvelles sont formées. Chez les autres
formes de croissance l'agrandissement de la colonie s'effectue également
dans les zones extérieures.
En déterminant à intervalles réguliers la prise de
poids d'une colonie, il est possible d'évaluer la quantité
de carbonate de calcium produite en une période donnée.
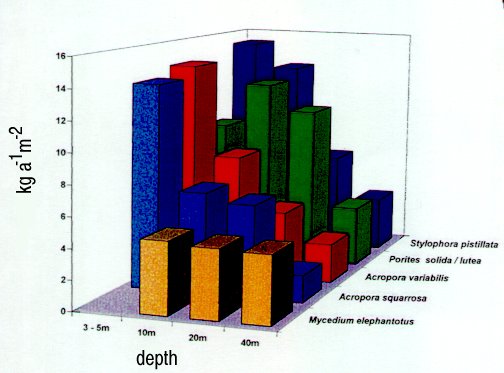
L'augmentation de poids des scléractiniaires en fonction de l'espèce
et de la profondeur se situe entre 3 et 15 kilos par mètre carré
de surface de colonie et par an dans le golfe d'Akaba (Schlichter et al.
1996). La proportion de production de calcaire de diverses espèces
situées à la même profondeur se différencie
et la profondeur augmentant la même espèce produit moins
de calcaire. Il existe cependant des exceptions à cette règle:
la production de calcaire de Mycedium elephantotus est identique
à toutes les profondeurs.
La lumière solaire influence la production de calcaire
II faut cependant savoir qu'avec l'augmentation de la profondeur, comme
déjà évoqué, non seulement les conditions
de lumière changent mais d'autres facteurs écologiques ayant
une influence également. Dans le golfe d'Akaba, la production de
carbonate était réduite d'environ 75 % par 40 mètres
de profondeur comparée à celle par 5 à 10 mètres.
Ceci est en relation de manière prépondérante avec
l'irradiation solaire en diminution dans les profondeurs plus importantes
et de la production primaire plus faible par les zooxanthelles qui en
résulte. Il est possible de mettre en évidence le même
rendement des zooxanthelles en évaluant l'activité journalière
de la production de calcaire. Durant la journée elle est 20 fois
plus importante que durant la nuit. Une explication de cette différence
est toujours aussi difficile, quoique le phénomène soit
déjà connu depuis des décennies.
L'efficacité de la lumière c'est à dire l'influence
de la photosynthèse des zooxanthelles sur la production de calcaire
trouve aussi une confirmation dans la dépendance à la profondeur
évoquée et dans la saisonnalité de la production
de carbonate. Dans le golfe d'Akaba (29° C, 30 'N) il y a un cycle
journalier et annuel marqué de l'irradiation solaire. L'intensité
du rayonnement et la durée d'ensoleillement sont plus faibles durant
les mois d'hiver, en comparaison avec les mois d'été. La
température dans le golfe d'Akaba a une influence, et encore ce
n'est pas sûr, sur la biocalcification dans les dix mètres
supérieurs, car à partir d'une profondeur de dix mètres
jusqu'à 1600 mètres règne une température
restant égale de 20 à 22° C. Dans l'eau superficielle
il se produit des variations au cours de l'année qui atteignent
environ 2° C à dix mètres de profondeur et 4 à
6° C entre deux et trois mètres pour une durée très
courte. Il n'y a pas de modifications de salinité dans la Mer Rouge
qui peuvent avoir un effet sur la production de carbonate; la quantité
de sel invariable se situe en permanence entre 40,5 et 41 %.
La croissance en longueur est très variable chez les différentes
espèces et se monte en moyenne entre 7 et 16 millimètres
par an chez les espèces branchues de la Mer Rouge; dans d'autres
mers ces valeurs ont atteint un maximum de 265 millimètres. Les
formes massives, hémisphériques ont une croissance en longueur
plus réduite (Schlichter et al. 1996).
Production de carbonates et zooxanthelles
 L'exosquelette
est constitué de carbonate de calcium et les pierres de construction
nécessaires pour cela, les ions calcium et carbonate, sont disponibles
dans la mer sous forme dissoute. La performance des scléractiniaires
réside dans le fait qu'ils modifient tellement les conditions physico-chimiques
que les ions dissous sont accumulés puis font défaut dans
la solution et que des cristaux d'aragonite se forment. Je n'aborderai
pas les détails de la réaction chimique dans cet article.
Un signe que la biocalcification a ses propres règles, bien que
les processus qui s'y déroulent ressemblent à ceux au cours
desquels du carbonate de calcium se produit dans la Nature, est cependant
nécessaire: avant que la formation du squelette d'aragonite ne
se produise, le tissu épidermal sécrète (couche de
tissu extérieur) du mucus sur lequel se fait la précipitation
des cristaux de calcaire, ce qui signifie que le mucus produit par les
coraux jour un rôle décisif dans la formation biogène
des cristaux et de la croissance du squelette.
L'exosquelette
est constitué de carbonate de calcium et les pierres de construction
nécessaires pour cela, les ions calcium et carbonate, sont disponibles
dans la mer sous forme dissoute. La performance des scléractiniaires
réside dans le fait qu'ils modifient tellement les conditions physico-chimiques
que les ions dissous sont accumulés puis font défaut dans
la solution et que des cristaux d'aragonite se forment. Je n'aborderai
pas les détails de la réaction chimique dans cet article.
Un signe que la biocalcification a ses propres règles, bien que
les processus qui s'y déroulent ressemblent à ceux au cours
desquels du carbonate de calcium se produit dans la Nature, est cependant
nécessaire: avant que la formation du squelette d'aragonite ne
se produise, le tissu épidermal sécrète (couche de
tissu extérieur) du mucus sur lequel se fait la précipitation
des cristaux de calcaire, ce qui signifie que le mucus produit par les
coraux jour un rôle décisif dans la formation biogène
des cristaux et de la croissance du squelette.
En réfléchissant à l'explication de l'influence des
zooxanthelles sur la sécrétion des carbonates, une constatation
doit être prise en considération. La croissance de colonies
de coraux en forme de buissons ou d'arbres se différencie très
nettement dans les diverses zones d'une seule et même colonie. Les
branches terminales croissent jusqu'à 40 fois plus vite que les
latérales.
On discute aujourd'hui diverses hypothèses, afin de savoir comment
les zooxanthelles influencent la production de carbonates. L'hypothèse
d'extraction ou de consommation prend pour base la constatation évoquée,
selon laquelle la sécrétion de calcaire est nettement plus
importante durant le jour que durant l'obscurité. Par l'extraction
(consommation) du gaz carbonique par les zooxanthelles le pH augmente
dans les tissus et dans le liquide du système gastrovasculaire.
La montée du pH a un effet renforcé sur la sécrétion
de carbonate de calcium, car il ne reste pas en solution dans la zone
alcaline (Goreau 1959).
Par analogie cette argumentation s'applique aussi à la consommation
des ions phosphates et ammonium. Les deux sont des éléments
constitutifs dont les zooxanthelles ont besoin pour la synthèse
des protéines et des phosphates riches en énergie, des lipides
et ainsi de suite. Si les phosphates et l'ammonium sont disponibles dans
l'eau de mer, ils ont une fonction de "poison à cristal",
c'est à dire que la formation de l'aragonite est perturbée.
Si les phosphates et l'ammonium sont consommés par les zooxanthelles
durant le jour, la production de carbonate de calcium s'en trouve augmentée.
L'effet présenté à l'instant des zooxanthelles rendrait
plausible l'augmentation de la productions de carbonate par la photosynthèse.
Il existe, et il ne faut pas le passer sous silence, bien sûr des
constatations expérimentales, qui ne confortent pas le mécanisme
décrit. Une objection importante est le fait que dans les pointes
des branches de coraux, donc là où se situe la production
de carbonate la plus importante, il n'y a pas de zooxanthelles dans le
tissu des coraux.
D'autres chercheurs en tirent l'hypothèse selon laquelle l'effet
stimulateur des zooxanthelles repose sur d'autres mécanismes. Un
groupe argumente que par la fourniture des photoassimilats plus d'énergie
est à la disposition des coraux pour la production de calcaire:
l'énergie pourrait par exemple entrer en action pour le transport
d'ions à travers la membrane cellulaire avec l'aide de pompes à
ions ou pour la synthèse des enzymes, qui sont nécessaires
à la sécrétion des carbonates. D'autres groupes de
chercheurs sont d'avis que les zooxanthelles fournissent des substances
augmentées, dont l'hôte a besoin pour la synthèse
des substances à base de mucus, nécessaires lors du premier
stade de la calcification biogène. Les deux essais précédents
d'explication sont en accord avec le fait que durant la journée
la proportion de carbonate de calcaire est plus importante que durant
la nuit.
Des analyses de scléractiniaires a zooxanthellates ont récemment
apporté des confusions supplémentaires dans l'élaboration
des hypothèses. Elles ont livré des preuves expérimentales,
selon lesquelles les scléractiniaires tropicaux sans zooxanthelles
sécrètent des carbonates en quantité comparable,
comme le font les espèces zooxanthellate (Marshall 1996). Ces résultats
sont cependant fortement controversés par les chercheurs établis.
Au large de la côte de la Norvège on trouve d'importants
bancs de coraux entre 200 et 600 mètres de profondeur par une température
de 3° C, qui sont presque exclusivement construits par deux espèces
de scléractiniaires a zooxanthellates (Lophelia pentusa, Madrepora
oculata). En outre il ya eu ou il y a des formations de "biocalcaire"
auxquels les scléractiniaires ont participé de manière
décisive ou pas: des récifs microbiens, des récifs
d'algues, des récifs de vers ou au cours des premières périodes
de la terre, des récifs de lamellibranches et des récifs
de brachiopodes. Dans cette mesure, il n'est pas possible de gager une
corrélation régulière entre formation de récifs
et scléractiniaires zooxanthellates. Il semble plutôt que
sous certaines conditions écologiques précises la construction
biogène de récifs peut se produire, où les producteurs
de calcaire peuvent cependant être d'espèces différentes.
Le succès évolutif des zooxanthellates actuels, espèces
de scléractiniaires coloniales des eaux tropicales et subtropicales
des récifs d'eau peu profonde se constate par leur position dominante.
Dans le combat long de millions d'années pour leur existence ils
ont concurrencés les espèces sans zooxanthelles en les excluant
presque complètement. Dans les récifs il n'existe qu'une
douzaine d'espèces sans zooxanthelles et dont la production de
carbonate n 'a que peu d'importance pour la croissance du récif.
La recette du succès des scléractiniaires zooxanthellates
Quelles aptitudes et quels caractères ont été
ou sont désormais la recette du succès des scléractiniaires
coloniaux hébergeant des zoxanthelles ?
Le plan de construction capable d'adaptation des scléractiniaires
a fait ses preuves dans ses traits fondamentaux depuis plus de 550 millions
d'années. La vie en colonies, c'est à dire la construction
à partir de sous-unités aux fonctions semblables, a apporté
des avantages en comparaison avec les existences individuelles. Par l'association
des coraux et des dinoflagellés il ya plus de 200 millions d'années
un organisme double a vu le jour avec de nouveaux caractères adaptatifs.
L'accouplement intracellulaire du métabolisme hétérotrophe
des coraux avec celui autotrophe des symbiontes a permis aux scléractiniaires
de devenir des "animaux parfaits". La combinaison était
idéale, car le métabolisme cellulaire des deux partenaires
repose sur les lipides. A ce propos, la liaison ne s'est pas seulement
révélée énergétique. Les algues symbiotiques
rendent les coraux capables d'une production de carbonate renforcée
ce qui signifie une croissance plus rapide, ce qui les a rendu apte à
éliminer par concurrence les espèces sans zooxanthelles.
La photoautotrophie fonctionnelle et le recyclage intracellulaire de la
matière ont rendu les coraux largement indépendants au plan
de la physiologie alimentaire en présence d'une luminosité
suffisante. Ceci a constitué l'avantage décisif lors de
la conquête des eaux oligotrophes chaudes à l'offre réduite
en zooplancton.
L'approvisionnement énergétique du système "coraux"
est à l'abri de crises extrêmes par les diverses stratégies
de nutrition. La photoautotrophie est le pilier principal de l'approvisionnement
énergétique; mais l'utilisation de composés organiques
dissous et la spécialisation sur des composants particuliers de
l'offre alimentaire particulaire contribuent considérablement à
un management alimentaire stable de l'ensemble du système.
Remerciements
Les recherches dans le golfe d'Akaba, à la "Marine Station
Aqaba", Jordanie, ont été soutenues par la "Deutschen
Forschungsgemeinschaft" (Schl 115/8-1 à 8-4). Je remercie
Madame H. Kapmann et Monsieur L. M. Kuhrau, qui ont mené les explorations
en pleine eau.
* Repris avec l'aimable autorisation de .. " Meer und Museum", Volume 14 ("Kora//enriffe - bedrohte Wildnis tropischer Meere") Schriftenreihe des Deutschen Museums für Meereskunde und Fischerei. Stralsund, 1998.
Glossaire
Adaptable: Basé sur l'adaptation
Aragonite : Minéral à base de carbonate de calcium, très
proche de la calcite.
Biocalcification : Dépôts de calcaire créés
par des êtres vivants.
Cavité gastrique: espace stomacal.
Chambre de respiration: Chambre close pour la mesure de l'activité
respiratoire (oxygène, gaz carbonique) des êtres vivants.
Cils: Poils des cellules vibratiles.
Coévolution: Evolution, au cours de laquelle les caractéristiques
d'une espèce se déroulent en dépendance de l'évolution
d'une autre espèce, par hasard chez les prédateurs et les
proies comme chez l'hôte et le parasite
Consommateur primaire: Organisme animal, qui se nourrit de plantes et
de bactéries. Consommateur secondaire : Organisme animal, qui se
nourrit de substances animales.
Cytoplasme: Partie de la substance vivante de la cellule moins différenciée,
qui entoure le noyau, les vacuoles et les divers organites.
Destructeurs: Matière organique morte de champignons et bactéries
ayant un pouvoir de dégradation.
Endolithique : Perforateur de pierre.
Enzyme: Substance organique produite par des cellules vivantes, qui agit
comme catalyseur dans les réactions biologiques.
Exocystose : Mécanisme permettant d'expulser hors d'une cellule
le contenu des granules qui sont entourées d'une membrane.
Exosquelette: Squelette extérier.
Gastroderme : couche de cellules internes des cnidaires.
Hétérotrophe: qui se nourrit de substances organiques, ne
peut effectuer lui-même la synthèse de ses éléments
constituants.
Laminaire: Régulier (courant sans tourbillon).
Lipide: Graisses.
Membrane de la vacuole : La membrane qui délimite une vacuole du
plasma cellulaire.
Oligotrophe : Pauvre en substances nutritives.
Photoassimilat : Liaison organique résultant de la photosynthèse.
Photoautotrophe : Se nourrissant par la photosynthèse.
Photosynthèse: Constitution de substances organiques à partir
de substances inorganiques avec l'aide de l'énergie de la lumière.
Phytoplancton: Plancton végétal.
Producteur primaire: Organisme qui élabore sa substance avec l'aide
de l'énergie du soleil.
Récent: Vivant actuellement.
Sédimentation: Dépôt.
Septes calcaires: Cloisons de séparation interne, radiale du calice
des coraux.
Septes : Voir septes calcaires.
Système gastrovasculaire : L'espace stomacal des cnidaires avec
l'ensemble de ses ramifications en forme de vaisseaux.
Toxine: Poison produit par les bactéries, les plantes ou les animaux.
Vacuole: Vésicule du plasma cellulaire remplies de liquide ou de
nourriture.
Zoochrome : Substance colorante formé par un organisme animal
Zooplancton: Plancton animal.
Bibliographie
Benson, A. A., & l. Muscatine (1974): Wax in coral
mucus: energy transfer from corals to reef fishes. limnol. Oceanogr. 19
:810-814.
Dunlap, W.C., & B. E. Chalker (1986) : Identification and quantification
of near UV absorbing compounds (S-320) in a hermatypic scleractinian.
Coral Reefs 5: 155-159.
-, - & J. K. Oliver (1986) : Bathymetric adaptations of reef-building
corals at Davies Reef, Great Barrier Reef, Australia. III; UV-B absorbing
compounds.
J. Exp; Mar. Biol. Ecol. 104 : 239-248.
Fricke, H. & H. Schuhmacher (1983) : The depth limit of Red Sea corals
: an ecophysiological problem. P.S. Z. N.I. Mar. Ecol. 4 : 163-194.
Gates, R. D., O. Hoegh-Guldberg, M. J. McFall-Nigai, K. Y. Bil & l.
Muscatine (1995: Free amino acids exhibit anthozoan "host factor"
activity: they induce the release of photosynthate from symbiotic dinoflagellates
in vitro. Proc.Natl. Acad. Sci. USA 92: 7430-7434.
Goreau T. F. (1959) : The physiology of skeleton formation in corals :
1. A method for measuring the rate of calcium deposition by corals under
ditferent conditions. Biol. Bull. 116 : 59-75.
Klinker, J., Z. Reiss, C. Kropach, 1. levnen, H. Harpaz & Y. Shapiro
(1978): Nutrients and biomass distribution in the Gulf of Aqaba (Eilat),
Red sea. Mar. Biol. 45 : 53-64.
Kühlmann, D. H. H. (1983): Composition and ecology of deep water
coral associations. Helgolander Wiss. Meeresunters. 36 : 183-204.
Marshall, A. T. (1996) : Calcification in hermatypic and ahermatypic carats.
Scien 271 : 637-639. W Riedl, R. (1969) : Marinbiologische Aspekte der
Wasserbewegung. Mar. Biol. 4 : 62-78.
Roberts, H. H., P. M. Stephen & J. N. Suhayda (1976): Physical processes
in a fringing reef system. J. Mar. res.23 : 233-260.
Schlichter, D. (1982) : Epidermal nutrition of the alcyonarian Heteroxenia
fuscescens (Ehrb ;) : Absorption of disoolved organic material and lots
endogenous photosynthates. Oecologia 53: 40-49.
- (1983): Ernahrungsstrategien von Nesseltieren . Verh. Ges. ôkol.
(Mainz 1981) X: 591-603.
-, A. Svoboda & B. P. Kremer (1983): Functional autotrophy of Heteroxenia
fuscescens (Anthozoa, Alcyonaria): Carbon assimilation and translocation
of photosynthates from symbionts to hosto Mar; Biol. 78: 29-38.
-, W. Weber & H. Fricke (1985): A chromatophore system in the hermatypic,
deep water coral leptoseris fragilis (Anthozoa: Hexacorallia). Mar. Biol.
89:143-147.
-,& H. W. Fricke (1991): Mechanisms of amplification of photosynthetically
active radiation in the symbiotic deep water coral Leptoseris fragilis.
Hydrobiologia 216/217 : 389-394.
-, U. Meier & H. W. Fricke (1994): Improvement of photosynthesis in
zooxanthellate corals by autofluorescent chromtophores. Oecologia 99 :
124- 131. ;
-, D. Zscharnack & H. Krisch (1995): Transfer of photoassimilates
from endolithic algae to coral tissue. Naturwissenschaften 82: 561-564.
-, S. Conrady, H. Kampmann, A. Klüter, H. Krisch, L. M. Kuhrau &
B. Zscharnack (1996): Carbonate production of scleactinians in dependence
upon the availability of food and the trophic potentiel of endolithic
algae. ln : Reitner, J., F. Neuweiler & F. Gunkel (Hg.): Global and
regional contrais on biogenic sedimentation. 1. Ref Evolution. Research
reports. Göttinger Arb. Geol. Palaont. Sb 2: 111-118.
-, H. Kampmann & S. Conrady (1997): Trophic potential and photoecology
of endolithic algae living within coral skeletons. P. S. Z. N. Mar. Ecol.
18 : 299-317.
-, & H. Brendelberger (1998) : Plasticity of the scleractinian body
plan: functional morphology and trophic specialization of Mycedium elephantotus
(Pallas, 1766). Facies 39: 227-242.
Schuhmacher, H., & H. Zibrovwius (1985): What is hermatypic? Coral
reefs 4: 1-9.
Shibata, K. (1969) : Pigments and a UV- absorbing in corals and a blue-
green alga living in the Great Barrier Reef. Plant and Cell Physiol. 10:
325-335.
Shick, M. (1991) : A functional biology of sea anemones. London.
Sorokin, Y. 1. (1993) : Coral Reef Ecology. Hamburg.
Stanley, G. D. Jr., & P. K. Swart (1995) : Evolution of the coral-
zooxanthellae symbiosis during the Triassic : a geo-chimical approach.
Paleobiology 21: 179-199.
Stochaj, W. R., W. C. Dunlap & J. M. Shick (1994): Two new UV- absorbing
mycosporine like amino acids from the sea anemone Anthopleura elegantissima
and the effects of zooxanthellae and spectral irradiance on chemical composition
and content. Mar. Biol. 118: 149-156.
Yonge, C. M. (1973): Coral reef project. Papers in memory of Dr. Thomas
F. Goreau. The nature of reef building (hermatypic) corals. Bull. Mar.
sci. 23: 1- 15.
L'auteur
Dieter Schlichter est professeur à l'Institut de Zoologie de l'Université
de Cologne et il se consacre à l'écophysiologie des organismes
récifaux. L'approvisionnement énergétique et la production
de carbonates des scléractiniaires est examinée. En outre
l'auteur est intéressé par la découverte des processus
et facteurs actifs qui jouent un rôle dans la croissance des récifs
tropicaux d'eau peu profonde.
Autres informations sur Internet: www.uni-koeln.de/math-nat-fak/zoologie
© Extrait de la Gazette Marine N° 76 -
juillet 2003
Publication réservée aux membres des Amis de l'Aquarium
1932.
