 L'ADAPTATION
DES EAUX
L'ADAPTATION
DES EAUX
par Renaud LAVIGNE. (Revue Aquarama, 1990)
Les aquariophiles désireux de réaliser des aquariums
biotiques ou de réussir des reproductions délicates, se
voient contraints de disposer d'eaux dont les caractéristiques
sont parfois fort éloignées de celles de l'eau de conduite.
Cet article donne des conseils pratiques pour modifier les trois paramètres
principaux que sont la salinité, la dureté et le pH.
NOTIONS SIMPLES DE CHIMIE DES EAUX
Pour bien comprendre ce que sont la salinité, la dureté
et le pH, voici quelques rappels élémentaires de chimie:
la matière est constituée d'atomes, eux-mêmes formés
de particules telles le proton et l'électron. Ainsi, l'atome comportant
1 proton est appelé "Hydrogène"; celui en comportant
8 est appelé "Oxygène" celui en comportant 92
est appelé "Uranium", etc. A chaque atome correspond
un nombre unique de protons.
Plusieurs atomes peuvent se combiner entre eux pour former une molécule,
qui est l'entité, la plus petite ayant les propriétés
de la matière qui en est composée. Par exemple, la molécule
d'eau, de formule H20, est formée de 2 atomes d'Hydrogène
(H) et d'1 atome d'Oxygène (0). Une molécule d'eau possède
les mêmes propriétés que toute l'eau des Océans
et ces propriétés sont différentes de celles des
atomes d'Hydrogène et d'Oxygène qui la constituent.
Les atomes, comme les molécules sont électriquement neutres
car ils renferment autant d'électrons (de charge négative)
que de protons (de charge positive): il y a 1 électron dans l'atome
d'Hydrogène, 8 dans celui d'Oxygène ...
Là où les choses viennent à changer, c'est justement
dans l'eau! En solution aqueuse, les espèces chimiques sont présentes
sous forme d'ions, c'est-à-dire d'atomes ou de molécules
dont la charge électrique n'est plus nulle, parce que le nombre
d'électrons n'est plus égal au nombre de protons. Il existe
donc des ions chargés négativement (ayant plus d'électrons
que de protons, nommés anions) et des ions chargés positivement
(ayant plus de protons que d'électrons, nommés cations).
Ainsi, l'Oxygène (8 protons + 8 électrons) donne l'ion appelé
"Oxyde" qui a 2 électrons en plus et dont 18 symbole
chimique est donc 02-; de même, l'Hydrogène (1
proton + 1 électron) donne l'ion appelé "Hydronium"
qui a 1 électron en moins et qui est symbolisé H+.
Comme la matière est globalement neutre (on ne ressent pas d'électricité
en touchant l'eau), il y a toujours assez d'ions chargés positivement
pour neutraliser les ions chargés négativement et vice-versa.
Lorsqu'ils s'associent, ils forment ce que l'on nomme un "sel".
C'est de ces différents sels ou ions que dépend la qualité
d'une eau et c'est à partir d'eux qu'on définit les notions
de salinité, dureté ou pH.
LA SALINITE
DEFINITION:
La salinité, comme l'indique le terme (une fois n'est pas coutûme!),
représente la concentration totale en sels contenus dans l'eau.
Rappelons que pour le chimiste, un sel est l'assemblage de deux ions de
charges électriques opposées, quels qu'ils soient, et non
uniquement le sel qu'on ajoute aux aliments, qui est composé de
l'anion chlorure et du cation soldium. Des dizaines d'ions négatifs
(bicarbonate, sulfate, chlorure, nitrate .. .) et d'ions positifs (calcium,
magnésium, sodium, potassium, cuivre . . .) peuvent résulter
de centaines de sels différents!
MESURE:
La salinité se mesure en mg/I mais n'est pas usitée des
aquariophiles. On lui préfère la conductivité, mesurée
en uS/cm2. La conductivité est la capacité d'une eau à
conduire le courant électrique. Elle est donc proportionnelle à
la concentration en ions (chargés électriquement, nous l'avons
vu) et donc à la concentration en sels. Et voilà! Le problème
est que les ions ne conduisent pas tous le courant de la même façon,
si bien que la corrélation conductivité-salinité
reste approximative. Mais cela n'a guère d'importance pour l'aquariophile.
On considère ainsi qu'une conductivité de 100 µS/cm2
correspond à quelque 50 mg/I de sels. Une eau "moyenne"
contient environ 200 mg/I de sels et a une conductivité d'environ
400 µS/cm2; une eau douce renferme environ 50 mg/I de sel et a donc
une conductivité d'environ 100 µS/cm2; une eau dure, environ
1000, soit une conductivité d'environ 2000 µS/cm2; une eau
saumâtre, environ 10 000, soit 10 g/I, c'est-à-dire une conductivité
de l'ordre de 15 000 µS/cm2.
INTERET:
Pour de très hautes teneurs en sels, on peut corréler la
salinité à la densité, utilisée couramment
en aquariophilie d'eau de mer. La salinité est une mesure globale
qui est supérieure à la mesure de la dureté (cf.
plus loin) puisque tous les sels sont dosés, et l'on a donc ainsi
des renseignements importants concernant la qualité de l'eau. Ainsi,
l'eau de mer n'a pas une dureté aussi élevée que
ne le laisserait supposer sa très haute salinité car la
majeure partie de ses sels est constituée de chlorure de sodium,
sel qui n'intervient pas dans la dureté de l'eau. De même,
un aquariophile ayant traité un bac avec du sel (contre une maladie
ou pour acclimater des poissons d'eau saumâtre) et qui mesurerait
la dureté retrouverait la valeur originelle et ne pourrait savoir
ce qu'il a fait exactement, alors qu'une mesure de la salinité lui indiquerait
qu'il a ajouté du sel et dans quelles proportions! Ce qui est d'un grand
intérêt puisqu'il éviterait ainsi d'utiliser cette eau pour d'autres poissons,
qui, eux, n'apprécieraient pas forcément une teneur élevée en sel! A l'inverse,
le maintien de certaines espèces (Black-mollies, Guppy, Platies, Xyphos,
Etroplus, Telmatherina ...) sera favorisé dans une eau ayant
une conductivité de l'ordre de 5000 µS/cm2; les poissons d'eau saumâtre
ne seront à leur aise que dans une eau dont la conductivité dépassera
10 000 µS/ cm2. Dans une eau douce, de tels poissons peuvent rapidement
développer des maladies comme les mycoses.
CORRECTION:
Augmentation de la salinité:
Pour augmenter la salinité, il suffit d'ajouter du sel dans l'eau.
Le gros sel de cuisine fait l'affaire. Un ajout de 1 g de sel par litre
d'eau conduit à une augmentation de salinité d'environ 2000
µS/cm2.
Exemple: pour maintenir des vivipares, on choisit une conductivité
de 4000 µS/cm2 alors que l'eau a une conductivité de 1000
µS/cm2; il faudra ajouter (4000-1000)/ 2000 = 1,5 g/I de sel, soit
150 g pour 100 litres.
Diminution de la salinité:
Pour baisser la salinité, il faut diluer l'eau avec de l'eau moins
saline (plus douce). Généralement, l'aquariophile doit donc
avoir recours à de l'eau distillée, déionisée
ou osmosée, mais peut également utiliser des eaux minérales
très douces ou des eaux de source de sa région. Connaissant
la salinité S1 de son eau, la salinité S2 désirée
et le volume V2 voulu, il suffira de mélanger le volume V1 = (V2
x S2)/S, de son eau avec son complément (V2-V1) d'eau pure.
Exemple: à partir d'une eau de salinité égale à
1500 µS/cm2, on veut obtenir 100 litres d'eau de salinité
600 µS/cm2. On calcule V1 = (100 x 600)/1500 = 40 1. Il faut donc
mélanger 40 I d'eau usuelle avec 60 I d'eau pure.
 |
| En-Haut: Conductivimètre
L 17 En-bas: L 21 tous deux permettent de mesurer rapidement la conductivité de n'importe quelle eau. |
LA DURETE
DEFINITION:
La dureté totale (TH) est la grandeur caractérisant la concentration
en ions métalliques non alcalins, c'est-à-dire de tous les
cations qui ne sont pas en particulier hydronium (Hl, sodium (Na+)
ni potassium (K+). Partiquement, cela correspond à la
concentration en ions calcium (Ca++) et magnèsium (Mg++),
les autres cations concernés (aluminium, cuivre, fer . . .) étant
en concentrations bien moindres. On distingue la dureté temporaire
constituée par les anions carbonate (CO3+)
et bicarbonate (HCO3-), dont les teneurs peuvent
varier (d'où le nom), et la dureté permanente constituée
par les autres anions: sulfates (SO4-), chlorures
(Cr), nitrates (NO3-), nitrites (NO2
)...
On a donc: TH (dureté totale) = TAC (dureté temporaire)
+ TP (dureté permanente)
MESURE:
Ces duretés s'expriment en degrés (français chez
nous), le degré français étant défini comme
correspondant à une teneur de 10 mg/I du sel "carbonate de
calcium", trivialement appelé calcaire (1 = 0,56 °d).
Les tests aquariophiles donnent la valeur en degrés, mais le chimiste
peut calculer la dureté d'après la concentration en différents
ions; ainsi, on a les relations suivantes (les teneurs étant exprimées
en mg/l):
TH = 0,25 (Ca2+) + 0,411 (Mg2+)
+ 0,179 (Fe3+) + 0,371 (AI3+)
+ ...
TAC = 0,167 (CO32-) + 0,082 (HCO3-)
TP = 0,104 (SO42-) + 0,141 (CI-) + 0,081
(NO3-) + ...
 |
Généralement, on mesure les duretés totale (TH) et
temporaire (TAC) pour en déduire la dureté permanente, selon
TP = TH - TAC. Mais on peut approximer la dureté d'après
la salinité, sachant que 1 °f correspond à quelque 30
µS/cm2.
Le TH d'une eau naturelle est compris entre 5 °f et 20 °f dans
la plupart des cas. Le TH est un critère de potabilité d'une
eau et les eaux minérales, rarement très douces (justement
parce qu'elles sont "minérales"), peuvent être
très dures, voire non potables selon les normes européennes
en vigueur (Contrex: TH = 155 ou Vittel Hépar: TH = 184!).
Si le TH est inférieur à 5 °f, l'eau est dite très
douce; s'il est compris entre 5 et 10 °f, elle est douce; entre 10
et 20 °f, elle est moyennement dure; entre 20 et 40 °f, elle est
dure; au-delà, elle est très dure. Par abus de langage,
on dit également que l'eau est calcaire, alors que le calcaire
ne constitue qu'un des nombreux sels intervenant dans la dureté
de l'eau.
|
EAU
|
TH
|
| très dure |
40
°f
|
| dure |
20
- 40 °f
|
| moyennement dure |
10
- 20 °f
|
| douce |
5-10
°f
|
| très douce |
<5
°f
|
INTERET:
Longtemps appréciée comme un critère fondamental
pour la maintenance des espèces aquatiques, la dureté n'apporte
qu'une partie des informations qu'il convient de connaître puisqu'elle
ne tient pas compte des sels de sodium, de potassium et quelques autres,
qui peuvent néanmoins être en concentration extrêmement
élevée (eaux saumâtres). Cependant, elle reste une
mesure facile et effectuée couramment car, dans la majorité
des cas, les eaux analysées sont douces et peu salines, de sorte
que les concentrations en ions sodium et potassium sont peu influentes.
La dureté totale peut alors être corrélée avec
une bonne approximation à la salinité (1 °f = 30 µS/cm).
La connaissance de la dureté permet d'envisager un peuplement raisonnable
d'espèces, c'est-à-dire dont l'adaptation est facilitée
dans une telle eau. On connait en effet des espèces d'eaux très
douces (Discus, Rasboras, Characidée . .) ou dures (Vivipares,
Cichlidés . . .). La connaissance supplémentaire de la dureté
carbonatée (TAC) présente un intérêt certain.
En effet, les ions dosés au cours de cette analyse interviennent
directement dans ce que l'on nomme "effet tampon" (cf. pH) et
un TAC élevé (néanmoins toujours inférieur
au TH) permettra à l'eau d'amortir les fluctuations de pH et offrira
donc aux poissons un milieu plus stable, donc plus sûr.
 |
| Osmoseur à compresseur de Millipore |
CORRECTION
Diminution de la dureté:
Agir sur le TH revient à faire varier la concentration en sels
de calcium ou magnésium. Deux procédés s'offrent
à nous pour baisser la dureté:
- On dilue l'eau avec de l'eau pure (distillée, déionisée,
osmosée) ou très douce (de pluie, de source, Volvic . .
.). Connaissant le TH1, de son eau et désirant V litres
d'eau de TH2, on mélangera V1 = (V x TH2)/TH1
litres de son eau avec son complément d'eau pure (V2
= V - V1). Par exemple, si on désire 100 I d'eau à
TH = 15 alors que l'eau a un TH de 20, on mélangera V1 = (100 x
15)/20 = 75 l de son eau avec V2 = 100 - 75 = 25 I d'eau pure.
- L'ébullition de l'eau entraîne la précipitation
des carbonates sur les parois du récipient (le tartre). Le TH est
ainsi abaissé puisque le TAC est éliminé et la baisse
est donc fonction de la valeur originelle du TAC, qui peut être
nulle comme très importante. Cette méthode n'est cependant
pas recommandable car l'eau ainsi obtenue est privée de son pouvoir
tampon.
Augmentation de la dureté:
Si la diminution du TH par ajout de produits chimiques est impossible
en respectant les conditions biologiques, son accroîssement est
facile à réaliser par ce moyen. On pourrait, de la même
façon
que précédément, diluer son eau avec de l'eau pure,
mais ceci est souvent impossible car on dispose rarement d'une eau plus
dure que celle du robinet. Par conséquent, la méthode la
plus simple et très économique consiste à dissoudre
des produits chimiques qui vont augmenter la teneur en ions calcium ou
magnésium, c'est-à-dire d'ajouter des sels de ces deux métaux!
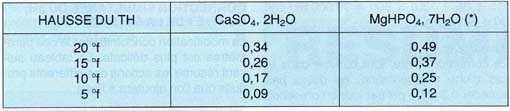
Voici les doses à utiliser, en g/I, pour deux sels différents,
l'un n'ayant pas d'action sur le pH: le sulfate de calcium (CaSO4);
l'autre, l'hydrogénophosphate de magnésium (MgHPO4)
entraînant une augmentation simultanée du pH, ce qui peut
être préférable, une eau dure étant naturellement
plus basique qu'une eau douce:
Par exemple, si l'on désire élever le TH de 50 I d'eau de
10 °f (pour ses Cichlidés préférés!),
on ajoutera 50 x 0,17 = 8,5 g de sulfate de calcium dihydraté;
si on veut élever le TH de 400 I d'eau de 15 °f, on ajoutera
400 x 0,26 = 104 g de ce sel.
 |
LE PH
DEFINITION:
Le pH est une grandeur caractérisant la concentration en ions H+
d'une solution. Plus le pH est faible, plus la concentration en ions H+
est grande, plus l'eau sera acide. Dans l'eau, il varie entre 0 et 14;
s'il est inférieur à 7, l'eau est dite acide (parce que
les acides ont la propriété de libérer des ions H+
en grand nombre); s'il est supérieur à 7, elle est basique
ou alcaline (parce que les bases ont la propriété d'appauvrir
l'eau en ions H+); s'il est de 7, l'eau est dite neutre (car
tous les ions H+ en excès sont neutralisés):
MESURE:
La valeur du pH résulte d'un artifice mathématique et s'exprime
sans unité (pas plus en mg/I qu'en cheval-vapeur). C'est un simple
nombre. A ce stade, une remarque: c'est que, du fait de cet artifice,
on oublie que la concentration en ions H+ varie énormément
plus vite que le pH. Ainsi, entre pH 6 et 7, il ne semble pas y avoir
beaucoup de différences, mais l'eau est dix fois plus acide dans
le premier cas! Entre deux eaux de pH 5 et 8, la différence est
d'un facteur 1000!
Pour fixer les idées, le pH d'une eau naturelle est généralement
compris entre 6 et 8; le pH de l'eau d'adduction est d'environ de 7 à
7,5; celui du vin de 4...
La mesure du pH s'obtient par méthodes colorimétriques (les
tests aquariophiles) ou électriques. Ces dernières utilisent
un appareil, le pH-mètre électronique, très précis
et dont les meilleurs modèles offrent un affichage direct de la
valeur sur un écran numérique à cristaux liquides.
 |
| Les pH-mètres analogiques ou digitales permettent un contôle plus précis des variations lors d'un ajustement |
INTERET
Le pH régit la plupart des réactions biochimiques ou chimiques
se déroulant en solution et peut donc fortement influer sur les
processus métaboliques. Un poisson plongé dans une solution
trop acide ou trop basique meurt rapidement (d'acidose ou d'alcalose).
Un symptôme fréquent d'une inadéquation d'une eau
est que le poisson se recouvre d'un voile blanchâtre, signe de l'agression
chimique que subit la peau; de même, si le poisson est brutalement
transféré dans une eau dont le pH est très différent
de celui de l'eau dont il est issu (par exemple, du pisciculteur au revendeur
ou du revendeur à l'amateur), il peut subir un stress chimique
conduisant à sa mort rapide. Ce paramètre est donc fondamental
en aquariophilie et son importance est d'ailleurs connue depuis longtemps.
De là, l'intérêt qu'une eau soit tamponnée,
c'est-à-dire que les fluctuations du pH soient faibles, même
si l'on y ajoute des acides ou des bases. C'est sans doute le test le
plus communément pratiqué. Les poissons d'eau douce nécessitent
un pH compris entre 6,5 et 7,5, certains, notamment les espèces
d'eaux très douces, demandant un pH légèrement infèrieur
(entre 6 et 7); d'autres, d'eaux calcaires, préfèreront
des valeurs plus élevées (entre 7 et 8). Les espèces
marines quant à elles, ne seront bien que dans des eaux dont le pH est
légèrement supérieur à 8 (8 à 8,5).
CORRECTION
Diminution du pH
Pour baisser le pH, il faut ajouter des acides dans l'eau. En effet, on
ne peut procéder par mélange d'eaux de pH différents,
du moins de façon rigoureuse, car il n'y a pas proportionnalité
entre la quantité d'acide d'une eau et son pH: ainsi, si on mélange
1 I d'eau de pH 7 avec 1 I d'eau de pH 5, on obtient certes 2 I d'eau,
mais le pH résultant est de 5,3 et non 6! Et encore s'agit-il d'un
cas idéal, car cela varie en plus selon le pouvoir tampon de l'eau!
A éviter donc, d'autant que d'autres paramètres, tels le
TH ou la salinité sont modifiés de façon incontrôlable.
On utilisera donc un produit comme l'hydrogénophosphate de sodium
(NaHPO4) ou le dihydrogénophosphate de potassium (KH2PO4).
Mais on ne peut cependant pas calculer a priori la quantité nécessaire
car celle-ci varie fortement selon la composition de l'eau, que la seule
connaissance de son pH et de son TH ou de sa salinité ne peut suffire
à déterminer. Par conséquent, ce sera l'expérience
qui permettra d'évaluer la dose nécessaire. A un litre de
votre eau, ajoutez la masse nécessaire (de l'ordre de 10 mg!) pour
abaisser le pH à la valeur désirée; cette valeur,
multipliée par le volume, en 1, de votre bac, vous indiquera la
quantité totale de produit à ajouter.
A titre indicatif, voici les ajouts approximatifs, en mg/I de KH2PO2PO4,
permettant de diminuer le pH d'une eau en fonction de sa dureté:
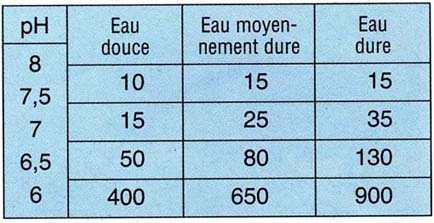 |
Exemple 1: on veut abaisser le pH de 120 I d'eau douce de 7,5 à
6,5: on additionne les chiffres compris entre ces deux valeurs, soit 15
et 50, ce qui donne 65. La dose s'obtient en multipliant ce chiffre par
le volume du bac: 65 x 120 = 7800 mg soit 7,8 g de KH2PO4.
Exemple 2: on veut abaisser le pH de 500 I d'eau dure de 8 à 6,5: il faut
ajouter (15 + 35 + 130) x 500 = 90 000 mg soit 90 g de KH2PO4.
Remarque:
La correction, lente, tout comme dans le cas d'une augmentation, ne devra
pas excéder 0,3 unité pH par jour en présence d'êtres
vivants, conséquence du fait que l'échelle de pH n'est pas
linéaire et qu'une telle correction correspond déjà
à une variation selon un facteur 2 de la concentration en ions
H+, c'est-à-dire de l'acidité! D'où l'intérêt
d'un pH-mètre électronique, qui seul permet un contrôle
sûr de l'opération.
Augmentation du pH:
Au lieu d'ajouter un acide (et à défaut de pouvoir en retirer!),
on ajoutera une base, telle le carbonate de sodium (Na2CO3)
ou l'hydrogénophosphate de calcium (CaHPO4). La méthode
à respecter est la même que celle décrite précédemment.
En outre, voici les quantités approximatives (dépendant
de la qualité de votre eau) de Na2CO3, en
mg/I, à ajouter en fonction de la dureté de l'eau (celle-ci
n'étant pas modifiée):
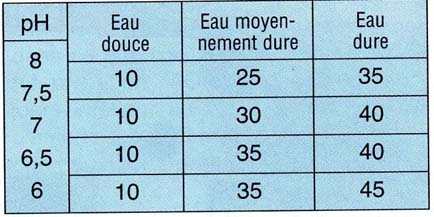 |
Exemple 1: on veut accroître le pH de 200 I d'eau moyennement dure
de 6 à 8: il faudra (35 + 35 + 30 + 25) x 200 = 25 000 mg soit
25 g de Na2CO3.
Exemple 2: pour augmenter le pH de 100 I d'eau dure de 7 à 8, on
ajoutera (40 + 35) x 100 = 7500 mg soit 7,5 g de Na2CO3.
Remarque:
Contrairement au bicarbonate de sodium (NaHCO3),
le carbonate de sodium peut être utilisé pour corriger le
pH d'eau de mer car il est plus basique et permet donc de dépasser
des pH de 8. J'ai moi-même obtenu de très bons résultats
en remontant le pH d'eaux de mer depuis 7,5 ou moins jusqu'à 8
à 8,5, et ce, sans aucun problème pour les poissons. Une
telle correction est impossible avec le bicarbonate de sodium et si l'eau
de mer présente un pH proche de 8, par exemple 7,8, l'addition
de ce produit ferait baisser le pH alors que quelques grammes de carbonate
de sodium suffisent pour corriger le pH d'un bac de 100 I.
CORRECTION SIMULTANÉE DU pH, DU TH ET DE LA SALINITÉ
La modification concomitante de ces paramètres est plus délicate.
Le tableau suivant résume les actions des différents produits
que l'on ajoutera à l'eau:
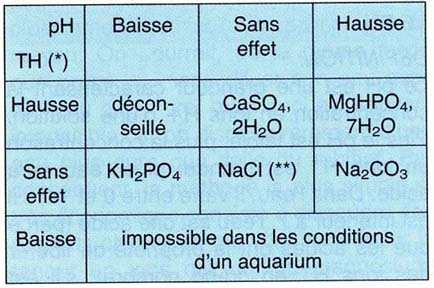 |
Dans le cas d'une augmentation simultanée du pH et du TH, on utilisera
donc MgHPO4, 7H20 pour d'abord corriger le TH, puis
Na2CO3 pour finir de corriger le pH si celui-ci
demeure trop bas. Si le TH est correct mais le pH trop fort, on ajoutera
KH2PO4. Si le TH est trop faible mais le pH correct,
on utilisera CaSO4, 2H20, etc. En ce qui concerne
les quantités à utiliser, on se réfèrera aux
tableaux et formules antérieurement donnés.
Exemple: on souhaite porter le TH de 100 I d'eau de 15 à 20 et
porter le pH de 6,5 à 7,5. On commencera donc par ajouter 0,12
x 100 = 12 g de MgHPO4, 7H20. Le pH aura légèrement
augmenté (par exemple jusqu'à 7) et il ne sera nécessaire
d'ajouter que la dose permettant de passer de pH 7 à pH 7,5. Pour
effectuer ceci, sans modifier le TH, maintenant bon, on utilisera du Na2CO3
à la dose de 35 mg/I soit 3,5 g en tout.
CONCLUSION
L'eau dont dispose les aquariophiles n'est que rarement adaptée
à l'usage que l'on veut en faire. Pour qu'elle soit compatible
avec les peuplements envisagés, on doit donc modifier ses caractéristiques.
Il est sûr que la meilleure méthode consiste à renoncer
à ses exigences et à porter son choix sur des organismes
pour qui cette eau serait convenable, mais de n'est généralement
pas la solution que l'aquariophile préfère. Quant au professionnel,
il ne peut se le permettre. Pour de nombreuses espèces, on doit
alors changer la qualité de l'eau, principalement sa dureté, sa
salinité et son pH. Hormis l'abaissement du TH, la simple addition de
produits chimiques idoines permet d'atteindre le but recherché à faible
coût et sans danger si l'on prend garde de respecter les conseils donnés
dans cet article.
OU TROUVER ...
LES PRODUITS CHIMIQUES?
Tous les produits chimiques recommandés dans cet article sont disposibles
chez PROLABO, dont les magasins se situent 48-50 Avenue du Groupe - Manouchian,
94400 VITRY s/Seine, et qui a de nombreuses succursales dans toute la
France.
LES INSTRUMENTS DE MESURE?
Conductimètres et pH-mètres électroniques sont indispensables
pour un contrôle sûr de toute opération visant à
modifier les qualités de l'eau. Une vaste gamme, bien étudiée,
est distribuée par la Pisciculture N'GUYEN, 9 rue du Hagelbach,
68260 KINGERSHEIM
| RÉSUMÉ Salinité: Augmentation: NaCI = chlorure de sodium = sel de cuisine Dureté: Augmentation: CaSO4, 2H20 = sulfate de calcium dihydraté MgHPO4, 7H20 = Hydrogénophosphate de magnésium heptahydraté = phosphate alcalin de magnésium heptahydraté pH: Augmentation: Na2CO3 = carbonate de sodium Diminution: KH2PO4 = dihydrogénophosphate de potassium phosphate acide de potassium Nota: si les produits ne contiennent pas la même proportion d'eau (par exemple: MgHPO4, 3H20 et non MgHPO4, 7H20), les quantités devraient, en toute rigueur, être réestimées (plus faibles quand il y a moins d'eau, plus fortes sinon), mais les valeurs conseillées sont approximatives et demeurent par conséquent un guide valable. Conductivité (µS/cm2): caractéristique d'une eau permettant d'en déduire sa salinité. Cette mesure est utilisable en eau douce comme en eau de mer. Densité (sans unité): correspond au poids de l'eau par rapport à celui de l'eau pure, dont la densité est de 1. Plus la densité est élevée, plus l'eau est riche en sel. Cette mesure n'est utilisée qu'en eau de mer, qui a une densité d'environ 1,023. Dureté (en °f ou °d): rend compte de la teneur d'une eau en sels de calcium et de magnésium, les deux sels les plus courants dans les eaux douces. Plus la dureté est élevée, plus l'eau est dure (moins elle est douce). pH (sans unité): détermine l'acidité ou la basicité d'une eau et doit être proche de 7 en eau douce et de 8 en eau de mer. Salinité (en mg/I): mesure la concentration de tous les sels contenus dans l'eau, notamment de calcium, magnésium, sodium et potassium. Cette mesure remplace celle de la dureté dans le cas des eaux saumâtres ou marines; elle est équivalente dans le cas des eaux douces. |
VALEURS GUIDES DE QUELQUES EAUX
|
t
(°C)
|
pH
|
TH
(°f)
|
c
(µS/cm2)
|
|
| Amérique du Sud |
26
|
6,6
|
5
|
100
|
| Amérique centrale |
25
|
7,8
|
20
|
500
|
| Fleuves africains |
25
|
6,4
|
5
|
100
|
| Lacs africains |
26
|
8,5
|
10
|
300
|
| Asie du Sud - Est |
26
|
6,6
|
5
|
100
|
| Mangroves |
27
|
7,5
|
-
|
15000
|
