 LE CHARBON
ACTIF
LE CHARBON
ACTIF
par Renaud LAVIGNE. (Revue Aquarama, 1993)
Le charbon actif est un matériau de filtration inutile selon
certains, formidable selon d'autres Toujours est-il qu'il est largement
employé par les aquariophiles! Faut-il le décrier ou faut-il
le blanchir? Cet article apporte des éléments de réponse.
 |
L'EAU, UNE RICHESSE EN PERIL:
Voilà quatre années déjà, j'attirais l'attention
des lecteurs d'Aquarama sur le fait que la pollution des eaux par les
nitrates semblait irréversible, car même l'arrêt immédiat
des épandages agricoles n'eût pas empêché la
contamination par les nitrates de l'eau des nappes phréatiques
de s'accroître. Ceci est dû à la faible vitesse de
migration verticale de ces ions à travers les sédiments
(on parle de "lixiviation"): les sols se comportent comme des
réserves de nitrates et leur lessivage par les eaux d'infiltration
peut requérir jusqu'à plus d'une décennie!
Ce n'était pas une prophétie, mais la simple constatation
de la réalité d'alors. Malheureusement, ces amères
assertions n'ont pas été démenties et l'on a assisté
depuis à de nombreux autres problèmes hydriques, dont certains
ont été portés à la connaissance du public
(Usine Protex sur la Loire en '88, Strasbourg et Amiens en 91, etc.) et
dont le plus célèbre, mais non le plus grave, est sans conteste
celui des phosphates (la "guerre des lessives")
En fait, tout ceci n'est là que pour nous rappeler, si besoin était,
combien l'eau est une denrée précieuse et fragile, et que
la qualité de la vie est grandement subordonnée à
la préservation des milieux naturels et des ressources en eau potable.
Celle-ci n'est envisageable qu'à la double condition d'une volonté
socio-politique (les organismes d'états, les collectivités
locales et territoriales) et d'un engagement personnel de chacun de nous.
L'Homme, pour s'être érigé en gestionnaire de notre
planète aurait fort à moins user de sa dévastatrice
puissance pour laisser parler sa raison, sinon son coeur: détruire
est le plaisir de ceux qui ne savent créer.
Quitte à faire bondir un certain nombre de mes semblables, je regrette
pour ma part que l'eau soit si bon marché car les gens n'ont pas
conscience de la richesse qu'elle constitue; ceux-là même
qui, souvent, sont prêts à payer l'eau quelque 200 fois le
prix de celle du réseau pour l'avoir embouteillée avec la
mention "minérale", mention qui n'est nullement gage
du fait que l'eau correspondante soit conforme aux critères de
potabilité! (Nombre d'eaux minérales ont des teneurs en
certains de leurs éléments constitutifs qui dépassent
les concentrations maximales admissibles (C.M.A.) pour l'eau potable.
A titre d'exemple, et sans que j'en veuille particulièrement au
groupe Perrier!, mieux vaut ne pas adorer Vichy St-Yorre car les valeurs
de plusieurs de ses composés dépassent allègrement
les C.M.A. correspondantes: sulfates, fluor (près de 6 fois!),
potassium (près de 9 fois) et sodium (plus de 11 fois!!) notamment;
usage déconseillé en aquariophilie, sauf avis vétérinaire
contraire ...)
Je me permets une rapide digression pour rappeler quelques règles
simples ayant pour but d'éviter une trop forte dégradation
de la qualité de nos eaux, et qui me semblent plus adéquates
pour protéger l'environnement que l'établissement de listes
positives! Elles devraient être suivies par tout individu et plus
rigoureusement encore par nous, aquariophiles, respectueux et amoureux
de la nature, qui devrions en faire une profession de foi, une éthique
dont la transgression ne devrait apporter qu'un sentiment de culpabilité
et de honte, tant vis-à-vis de nos concitoyens que de nos enfants
et des générations à venir. Si elles sauront nous
juger, elles ne sauront peut-être pas nous pardonner; peut-être
ne le pourront-elles pas ...
- Les prélavages de la vaisselle et du linge permettent de laver
plus facilement avec moins de détergents, ce qui est écologique
et économique (un simple jet d'eau froide suffit!).
- choisir sa lessive (et d'une façon générale, tout
ce que vous achetez!) en prenant en compte des critères environnementaux:
les lessives liquides sans phosphates sont plus polluantes parce qu'ils
y sont remplacés par des tensio-actifs, dont la teneur est alors
environ 4 fois plus élevée, ceci afin de compenser la perte
d'efficacité engendrée par l'absence de phosphates! Préférer
les lessives en poudre sans phosphates dans lesquelles ceux-ci sont remplacés
par des zéolites, inoffensives pour l'environnement.
- Respecter les conditions d'utilisation des lessives: certaines formules
sont conçues pour être efficaces à 40 °C car les
enzymes, d'origine biologique, sont le plus actives vers 37 °C. Le
linge sera donc moins bien lavé à 60 °C, et moins bien
encore à 90 °C! Inutile d'en mettre plus ou de vitupérer
le fabricant: mettez-en une autre ou modifiez votre programme de lavage!
- Surdoser les détergents et les nettoyants ménagers ne
permet pas de mieux nettoyer, pollue plus et coûte plus! Si l'eau
est douce, le linge ou la vaisselle peu sale, vous pouvez même en
mettre moins sans diminution notoire de l'efficacité .
- Pratiquement, tous les détergents sont biodégradables
à 90 % ou plus, et pour cause: la Loi l'impose! Un fabricant qui
s'en venterait ne ferait que profiter de la crédulité de
sa clientèle! Cette biodégradabilité apparemment
élevée ne doit pas pour autant nous donner bonne conscience
car les 10 % qui restent représentent une quantité phénoménale:
plus de 500 000 tonnes de lessives sont consommées chaque année
en France... Le produit biodégradable à 100 % et anodin
(rappelons qu'une hospitalisation pour intoxication sur six est imputable
à un produit domestique!) est le savon de Marseille, qui existe
sous forme de paillettes pour le linge.
- Ne pas rejeter de produits chimiques à l'égout (ou dans
l'évier, ce qui revient souvent au même!), notamment des
solvants organiques tels les détachants, les diluants ou les huiles:
les mettre en récipients clos à la poubelle ou, mieux encore,
les porter en un lieu où ils pourront être traités:
garages pour les huiles de vidange, déchetteries, etc.
- Ne pas laver son véhicule devant chez soi: les carburants, huiles
et métaux vont à l'égout ou dans les sols et se retrouveront
dans l'eau. Ces substances sont très nocives: 1 I d'essence suffit
pour polluer 1000 m3 d'eau!
Bien d'autres recommandations mériteraient d'être formulées,
y compris aux fabricants (lesquels accepteraient de concevoir plusieurs
formulations de lessive tenant compte de la qualité de l'eau?),
mais celles-ci me viennent à l'esprit et me semblent faciles à
respecter. Disposer d'une eau pure est le souhait de tous, poissons inclus!
Au fait, je ne l'ai pas mentionné et je sais pourtant que cela
arrive (eh oui!): ne pas nettoyer son aquarium, ni tout ce qui y rentre,
avec des produits ménagers!
Ce préambule n'a d'autre objet que de faire comprendre que la réalité
n'est pas la fatalité, que la protection de la nature, c'est-à-dire
de l'air, de la terre et de l'eau avant tout, est autant l'affaire de
chacun que des agriculteurs, des industriels ou des gens parfois compétents
qui nous dirigent. Nous sommes encore loin du temps où les consciences
individuelles rejoindront l'idéal collectif dans ce même
but et il nous faut faire avec ce dont nous disposons: une eau très
bon marché, aisément disponible mais de qualité quelquefois
aléatoire (je fais allusion à l'eau du réseau mais
qu'une eau soit de source ou de pluie ne présage en rien d'une
qualité supérieure!).
Les problèmes de pollution des eaux semblent se manifester de plus
en plus fréquemment et, sans sombrer dans un pessimisme exagéré,
grande est la tentation d'utiliser un matériau réputé
épurateur: le charbon actif.
FAISONS CONNAISSANCE .
Le charbon actif en aquariophilie:
Un matériau aura-t-il suscité autant de polémiques?
Dans d'anciens numéros d'Aquarama, je disais qu'il était
utile dans certains cas, mais qu'il valait mieux éviter d'y recourir,
tout simplement en respec
tant quelques principes de base: nourrir parcimonieusement, ne pas introduire
intempestivement des produits chimiques, changer une partie de l'eau regulièrement,
etc. Comme dans bien des cas, le flou qui subsiste résulte d'un
manque d'information. Pourquoi, en effet, l'aquariophile utilise-t-il
du charbon actif?
- Parce qu'un ami lui a recommandé (c'est alors le problème
de la poule et de l'oeuf!).
- Parce qu'il l'a lui-même expérimenté avec succès.
- Parce qu'il a été incité par un commerçant,
lui-même conseillé par le fabricant, dont on peut douter
de l'impartialité ... Le détaillant peut être un aquariophile
qui s'est tourné vers le commerce ou un commerçant qui s'est
converti à l'aquariophilie: si la probité risque de souffrir
du mercantilisme dans le deuxième cas, rien n'interdit de penser
qu'il peut en être ainsi dans le premier, même si cela devrait
être moins manifeste .. .
- Parce qu'il suit les conseils prodigués dans les livres ou les
revues. Et comme l'auteur met sa notoriété en jeu, il n'est
guère entrain à diffuser des billevesées, dût-il
pour cela paraître moins original! En outre, les écrits restent,
ce qui les rend criticables et permet donc de faire avancer la Science!
Dans tous les cas, demeure évidemment un problème de compétences.
car on peut dire en toute bonne foi d'énormes bêtises: "Le
problème est que les gens s'imaginent dire la vérité
alors qu'ils ne font que dire ce qu'ils pensent!" (J. Rostand).
Le but de cet article n'est pas tant de faire part de mon expérience
(subjective), que de relater les résultats de mes expériences
(objectives). Libre à chacun d'agir comme bon lui semble. Je ne
fais pas de physique quantique et ne connais pour ma part qu'une réalité;
en ce qui concerne le charbon actif, je me propose de vous l'exposer.
La nature du charbon actif:
Tout le monde sait que le charbon est constitué de carbone (d'où
le nom), le carbone étant cet élément à partir
duquel sont bâties toutes les molécules, dites organiques,
qui composent la matière vivante: les virus, les bactéries,
les végétaux et les animaux, vous et moi avec, referment
environ 1/3 de carbone! Les dames seront sans doute déçues
d'apprendre que les diamants ne sont que des cristaux très purs
de carbone et que ces augustes gemmes, loin d'être éternelles, brûlent
presque aussi bien que le noir graphite!
Le charbon actif est un composé carboné qui est généralement
fabriqué à partir de matières végétales
(bois, houille, tourbe . .). L'activation consiste à développer
sa porosité: il acquiert alors une forte capacité de fixation,
notamment vis-à-vis des molécules organiques (qui se ressemble,
s'assemble!). Cette activation est obtenue par pyrolyse à 600 °C
et oxydation ménagée, i. e. sous atmosphère pauvre
en oxygène, ceci afin qu'il ne se consume!
Il se présente en grains, d'une granulométrie de 0,25 à
3 mm et d'une densité apparente (apparente, car il est plein d'air!)
de 0,2 à 0,6, mais il peut s'acheter sous forme de poudre, ce conditionnement
étant bien moins onéreux.
Intérêt potentiel en aquariophilie:
Il peut être placé à demeure dans le filtre, dans
un filet, à l'instar de la pouzzolane ou de l'argile, assurant
un rôle épurateur à long terme: élimination
des substances nocives qui s'accumulent inévitablement dans un
aquarium un tant soit peu peuplé. Il peut également être
utilisé à titre curatif pour éliminer une pollution
aigüe: surdosage d'une préparation médicamenteuse ou
d'engrais par exemple.
Le charbon actif permet en effet de retenir de nombreux composés
susceptibles de polluer l'eau: alcaloïdes, colorants, hydrocarbures,
pesticides, solvants ou tensioactifs notamment. Son action est remarquable
pour dépolluer l'air, ce qui justifie son usage dans les masques
à gaz ou, plus prosaïquement, dans les semelles désodorisantes.
Utilisé comme stade ultime d'un processus de filtration, il assure
l'obtention d'une eau de grande pureté et est à ce titre
très utilisé dans les laboratoires, mais également
dans les stations d'épuration.
Mécanisme mis en jeu:
Le phénomène de fixation d'une molécule à
la surface du charbon actif ou d'autres matériaux présentant
cette propriété (alumine, argiles, résines synthétiques
ou zéolites) est appelé "adsorption": il ne s'agit
pas d'absorption car il n'y a pas assimilation mais seulement rétention
en surface, cette rétention étant plus ou moins réversible
(Le phénomène inverse se dénomme "désorption").
Cette adsorption est donc un déplacement de molécules de
soluté (le polluant), du
solvant (l'eau) vers l'adsorbant (le charbon): (eau + polluant) + charbon
—> eau + (polluant + charbon)
Il en résulte un équilibre entre la concentration du polluant
dans l'eau et sa concentration sur le charbon: si a teneur dans l'eau
est élevée, et sous réserve que le charbon ne soit
pas saturé (cf. plus loin), les molécules se fixeront sur
ce dernier; si la teneur en polluant du charbon est très importante
alors que celle dans l'eau est faible, les molécules pourront être
désorbées, avec les problèmes que l'on imagine...
Il en va de même pour les résines échangeuses d'ions,
qui sont parfois utilisées en aquariophilie pour dénitrater
une eau: il peut y avoir relargage de nitrates dans l'eau, le risque devenant
très important en eau de mer!
L'adsorption est sous la dépendance de multiples facteurs:
- de l'adsorbant lui-même (le charbon actif) notamment de sa surface
spécifique, qui correspond à la surface développée
des pores du matériau et qui, de par de sa grande porosité
est énorme: 40 à 800 m2/ g de montmorillonite, 300 à
400 m2/g d'alumines acitvées, 300 à 750 m2/g de résines
synthétiques et 500 à 1300 m2/g de charbon actif! Un gramme
de charbon actif a par conséquent une surface d'échange
de quelque 900 m2!
- du soluté (le polluant), entre autres de sa taille moléculaire
(l'oxygène est une petite molécule, les protéines
sont des milliers de fois plus grosses), de sa concentration (plus il
y en a, plus il est adsorbé), de sa solubilité (un composé
peut être très soluble mais en faible concentration!) et
de sa charge électrique (les ions tels les nitrates sont chargés,
alors que la paraffine ne l'est pas);
- des paramètres externes comme l'hydrodynamisme (si le débit
est trop élevé, le charbon n'a pas le temps de retenir quoi
que ce soit!), le pH, la température ou la force ionique (la salinité
globale: phénomène d'adsorption compétitive en faveur
des composés les plus concentrés).
Propriétés d'adsorption du charbon actif:
Le charbon actif est caractérisé par un très large
spectre d'adsorption et peut donc retenir une grande variété
de produits, ce qui explique le fait qu'il entre dans la composition de
l'antidote universel
(avec la magnésie et les tannins) que l'on fait assimiler, per
os, en cas d'intoxication aigüe. Il n'élimine néanmoins
pas toutes les molécules avec la même efficacité:
ainsi, l'endrine (un pesticide) est 700 fois mieux adsorbée que
l'EDTA (un agent chélateur utilisé dans les engrais pour
faciliter l'absorption du fer par les plantes).
En règle générale, l'adsorption croît avec
la taille de la molécule et son hydrophobie (propriété
qui caractérise les molécules peu solubles dans l'eau):
les molécules organiques, souvent grosses et en principe lipophiles
(donc hydrophobes), sont par conséquent bien retenues tandis que
les molécules minérales, comme les sels, le sont peu: dans
le cas contraire, nous ne pourrions nous en servir en aquariophilie marine
car il dessalerait l'eau!
Voici quelques valeurs de pouvoirs de rétention exprimées
en mg de produit pour 1 g de charbon actif, qui permettent d'apprécier
la grande variabilité existant en ce domaine puisque l'adsorption
varie au-delà d'un facteur mille:
Heptachlore (pesticide): 1200
naphtalène (antimite): 130
EDTA (chélatant): 0,9
DDT (pesticide): 320
toluène (solvant): 86
Ainsi, un gramme de charbon actif retiendra plus de sa propre masse d'heptachlore,
mais ne retiendra que très mal l'EDTA.
Autres propriétés du charbon actif:
Outre sa capacité d'adsorption exceptionnelle, le charbon actif
agit comme catalyseur, c'est-à-dire qu'il facilite énormément
certaines réactions chimiques: pour faire image, les roues d'une
automobile servent de catalyseur pour son déplacement; essayez
donc de pousser votre véhicule sans les roues: ce sera pratiquement
impossible, et pourtant... il sera moins lourd!
Ainsi, le charbon actif est remarquable pour sa faculté de déchlorer
l'eau, selon la réaction:
2CI2(chlore) + 2H2O(eau) —> 4HCI(acide)
+ O2(oxygène)
Il élimine donc l'excès de chlore que peut contenir une
eau traitée et fait, à ce titre, le bonheur et la richesse
de fabricants de filtres s'adaptant sur les robinets.
Sa forte porosité en fait un support de choix pour les bactéries,
qui, de plus, y trouvent pitance puisqu'elles peuvent dégrader
les molécules adsorbées.... Ce qui rend les ustensiles précédemment
évoqués fort criticables car ces filtres, vendus avec "l'épuration
de l'eau" comme argument, constituent rapidement de véritables
"nids à bactéries" et deviennent plus dangereux
que les produits censés être éliminés, d'autant
que la faible masse de charbon est vite saturée et ne peut jouer
son rôle épurateur bien longtemps...
L'ELIMINATION DES MATIERES MINERALES
Expérimentation:
J'ai procédé à des expériences selon un protocole
scientifique rigoureux afin de juger de l'intérêt réel
de l'utilisation du charbon actif en aquariophilie, étant bien
entendu que ses qualités sont par ailleurs indéniables (tout
comme les qualités de la navette spatiale le sont, bien que ce
ne soit pas le moyen de locomotion le plus adapté pour se rendre
à son travail . . .).
Parmi les conditions expérimentales retenues, la quantité
de charbon actif utilisée était de 10 g par litre (soit
1 kg pour 100 I), ce qui constitue, a priori, une bonne proportion; le
temps de contact a été de 1 h, ce qui est considérable
et laisse au charbon le temps de retenir tout ce qu'il est capable de
retenir; les essais ont été réalisés sur une
eau d'un aquarium d'eau douce en service depuis plusieurs mois et sont
donc parfaitement représentatifs de conditions normales! Les concentrations
sont volontairement élevées et il n'y en avait pas autant
dans l'aquarium, heureusement pour les poissons! J'ai en fait dopé
l'eau, i. e. ajouté une certaine quantité de sels correspondants:
par exemple du sulfate de cuivre dans le cas du cuivre. A cela deux raisons:
d'abord parce que le charbon est supposé neutraliser une pollution,
qui, par définition, correspond à des teneurs importantes;
ensuite, afin d'approcher au mieux ses capacités réelles
et de minimiser l'imprécision du résultat.
J'ai testé les capacités de rétention du charbon
actif sur la trilogie azotée constituant la bête noire de
tout aquariophile, à savoir les ions ammonium, nitrite et nitrate
(les premiers ne sont que très peu toxiques mais sont susceptibles,
à la faveur d'un accroissement du pH, de se transformer en ammoniac,
qui est un poison; de plus, leur biodégradation génère
des nitrites, très toxiques). Comme autre anion, j'ai choisi le
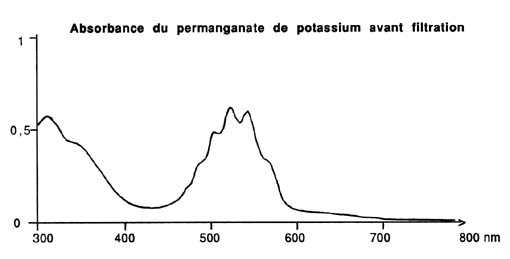
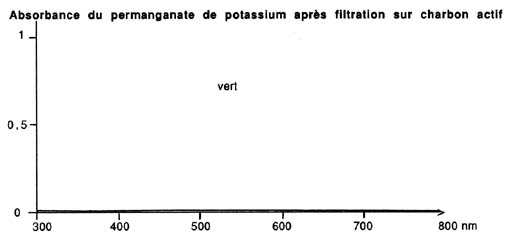
permanganate, qui est un remarquable désinfectant et un bon traceur
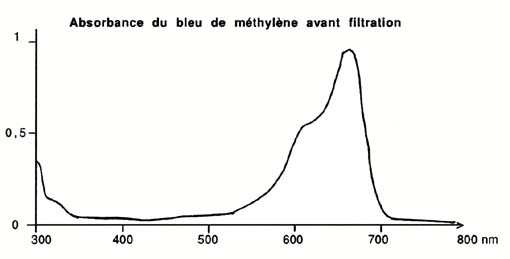
de l'efficacité du charbon puisque coloré: on pourra en
juger en se reportant aux spectres d'adsorption lumineuse présentés
en illustration, sachant que la lumière visible s'étage
entre 390 et 800 nm (un produit coloré absorbe forcément
la lumière visible). En outre, j'ai également pratiqué
la même manipulation avec deux métaux couramment utilisés
dans notre hobby: le cuivre, comme médicament quasi-universel,
et le fer, comme oligoélément constitutif des engrais. Ceci
était nécessaire car un métal n'a pas du tout le
même comportement physico-chimique qu'un ion tel que le nitrate.
Enfin, pour que l'essai soit complet, j'ai vérifié l'action
du charbon actif sur le chlore, qui est très utilisé pour
assurer une grande propreté bactériologique à l'eau
du robinet et qui a aussi un comportement différent.
Résultats:
Je ne ferai pas durer le suspense! Les résultats sont regroupés
dans le tableau suivant et sont la moyenne de plusieurs analyses, ceci
afin de s'affranchir des risques, toujours possibles, d'erreurs et de
réduire l'incertitude expérimentale:
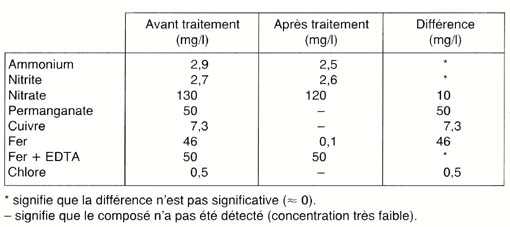 |
Ces résultats doivent être assortis du commentaire suivant:
même en supposant un faible adsorption, de l'ordre du mg/g, une
teneur de 10 mg/I eût donc due être adsorbée avec 10
g de charbon actif par litre. Ceci justifie a posteriori les concentrations
relativement élevées retenues.
Commentaires:
En fait, les chiffres sont souvent bien plus défavorables encore!
L'adsorption de l'ammonium et des nitrites n'est pas significative, c'est-à-dire
qu'ils sont peut-être retenus, mais alors très faiblement.
L'adsorption des nitrates est réelle mais très faible: environ
10 mg/I: elle est donc très insuffisante car il n'est pas rare
d'avoir plusieurs dizaine de milligrammes par litre, voire plusieurs centaines!
L'élimination du permanganate a été totale, même
s'il ne s'agit pas réellement d'un phénomène d'adsorption
(cet ion est un puissant oxydant qui réagit avec la matière
organique), et malgré la relativement forte teneur utilisée.
Les ions métalliques cuivrique (Cu2+) et ferreux (Fe2+)
ont des caractéristiques similaires, de sorte que leur adsorption
est voisine: elle semble meilleure, mais, de toutes façons, comme
ces ions se retrouvent dans l'eau en faibles concentrations, on peut dire
que leur élimination est totale. Par contre, lorsque le fer est
chélate par l'EDTA (j'ai ajouté la quantité juste
nécessaire d'EDTA pour complexer les 50 mg/I de fer), il ne se
comporte plus comme un métal: rendu plus stable (d'où l'utilisation
de l'EDTA dans les engrais, pour maintenir une teneur en fer assimilable
élevée), il n'est plus adsorbé. Ceci signifie qu'une
filtration sur charbon actif risque d'éliminer le fer de l'eau
... sauf si vous avez utilisé de l'EDTA (ou d'autres choses: nous
en reparlerons dans un prochain article ...)
Enfin, l'élimination du chlore est patente et, du fait qu'il s'agisse
d'un processus catalytique, il n'y a pas "usure" du charbon
actif: la quantité de chlore éliminée ne dépend
pratiquement pas du volume d'eau à traiter. Pour juger de la représentativité
de la concentration retenue, il faut savoir qu'une eau potable traitée
a rarement plus de 0,05 mg/I de chlore libre!
Le tableau qui suit synthétise ces observations en présentant
les capacités d'adsorption du charbon actif testé, calculées
d'après les valeurs précédentes, ainsi que les quantités
nécessaires pour éliminer une certaine concentration de
l'élément considéré:
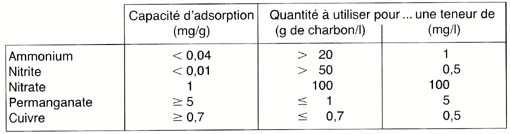 |
Ainsi, si l'eau de votre aquarium a une concentration en nitrates de 100
mg/I, ce qui n'est pas exceptionnellement élevé!, 100 g
de charbon actif par litre d'eau devraient suffire, soit 10 kg pour 100
l !! Pour lutter contre une montée de nitrites (0,5 mg/l), il faudrait
au moins 50 g de charbon actif par litre, soit au moins 5 kg pour 100
l ! En ce qui concerne l'ammonium, au moins 20 g de charbon actif par
litre d'eau seraient nécessaires pour éliminer 1 mg/I, c'est-à-dire
au moins 2 kg pour 100 l, mais, à l'instar des nitrites, le résultat
n'est pas garanti...
Lorsqu'il s'agit de l'ion permanganate, dont on peut craindre un excès
consécutivement à un traitement, le charbon actif se révèle
fort efficace pour l'éliminer puisque, en supposant une teneur
très importante de 5 mg/I, 100 g de charbon actif suffiraient largement
pour traiter un aquarium de 100 I ! Dans le cas d'un traitement classique,
volontaire et bien dosé, le charbon se révélerait
un fauteur de troubles (si l'on peut dire!) car il éliminerait
de l'eau le principe actif même du médicament! Autant dire
que ce dernier ne serait pas particulièrement efficace...
Pour le cuivre, les mêmes remarques s'appliquent: il faut savoir
qu'un traitement conduit à une concentration d'au moins 0,25 mg/I,
soit au moins 1 mg/I de sulfate de cuivre pentahydraté. Si on imagine
une erreur de dosage qui conduise à une teneur décuple,
soit 2,5 mg/I de cuivre, il faudrait, pour y remédier, moins de
3,5 g de charbon par litre d'eau, ce qui est très peu. Ceci est
donc un avantage lors d'un surdosage, de traitements répétés
ou d'utilisation accidentelle en présence d'invertébrés
marins. Par contre, cela est fort ennuyeux lorsqu'on veut traiter par
le sulfate de cuivre et que le filtre renferme du charbon actif: le cuivre,
qui constitue le principe actif, sera retenu et, de facto, le traitement
sera inopérant!
L'ELIMINATION DES MATIERES ORGANIQUES
Expérimentation:
Les molécules organiques sont les "briques" de la matière
vivante: il y en a de petites, comme le méthane, grâce auquel
nous produisons de la chaleur (chauffage central, gazinière), dont
la masse molaire vaut 16 g; il en est de gigantesques, telles le protéoglycane,
constituant fondamental du cartilage, dont la masse molaire est de quelque
2 000 000 g . . . Peu importe de savoir ce qu'est la masse molaire: ces
chiffres montrent l'étendue de la gamme, d'autant qu'existent des
molécules plus grosses encore que le protéoglycane et que
deux molécules différentes peuvent avoir la même masse.
. . . Entre 16 et 16 000 000 g, vous conviendrez alors qu'il y a de la
place! Bref, la variété est proche de l'infini et les vies
entières de tous les hommes nés et à naître
ne suffiraient pas à tester les capacités d'adsorption de
toutes ces molécules par le charbon actif!
Aussi, bien que n'étant pas à l'orée d'un âge
canonique, je me suis limité à deux molécules: l'une,
très courante en aquariophilie d'eau douce, puisque relarguée
par les racines, la tourbe, la terre ou les feuilles: un tannin (acide
tannique); l'autre, parfois employée comme médicament et,
caractéristique concernant tout particulièrement cet article,
qui constitue un remarquable traceur: le bleu de méthylène.
Résultats:
Comme pour les molécules minérales, un tableau clarifie
l'exposé:
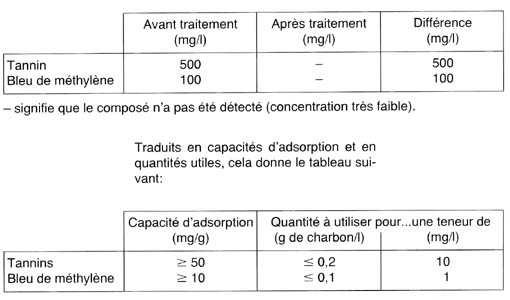 |
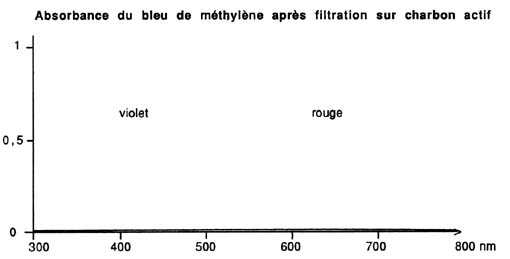
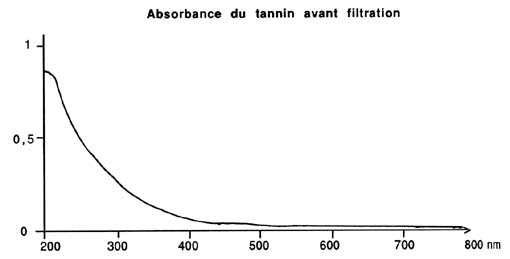
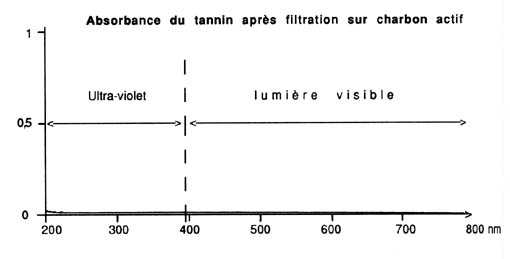
Les spectres figurant en illustration montrent combien l'élimination
est importante: les tannins absorbent la lumière bleue et les U.
V., c'est-à-dire le rayonnement de longueur d'onde inférieure
à 400 nm, car ils paraissent jaunes (cf. "Réflexions":
Aquarama n ° 115); le bleu de méthylène absorbe le rouge,
autour de 650 nm, puisqu'il est bleu.
Commentaires:
Les expériences ont été menées en respectant
les mêmes conditions opératoires que précédemment.
Les chiffres, initialement bien plus importants que dans le cas des substances
minérales, et les figures parlent d'eux-même: le charbon
a remarquablement éliminé ces molécules, malgré
des concentrations élevées: une eau contenant une dizaine
de mg/I de tannins est déjà jaune pâle, tandis qu'une
eau renfermant 10 mg/I de bleu de méthylène est d'un bleu
soutenu!
Si la teneur en tannins des 100 l d'eau de votre aquarium est de 10 mg/l,
il devrait suffire de 20 g de charbon actif au maximum pour les éliminer.
Quant au bleu de méthylène, l'adsorption est également
très forte, si bien que quelques grammes de charbon actif dépollueront
un important volume d'eau: voici des valeurs bien plus raisonnables que
les estimations concernant les nitrates par exemple!
UTILISATION:
La fonction première du charbon actif sera donc l'élimination
des polluants, quoiqu'en fait, il s'agisse plus justement d'un déplacement
de pollution car les polluants continuent d'exister! C'est le problème
que posent de nombreux procédés de dépollution...
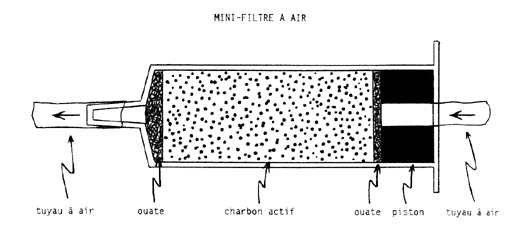
Afin d'éviter son colmatage ou sa rapide saturation, il est nécessaire
que l'eau lui parvienne clarifiée, ce qui peut être réalisé par décantation
suivie d'une filtration sur mousse synthétique, sable, roche volcanique,
diatomite, etc. (filtration sur coton dans le cas de l'air: voir le schéma
d'un mini-filtre à air fabriqué avec une seringue).
 |
Le volume à mettre en œuvre est idéalement du dizième
du débit horaire, soit, par exemple, 201 avec une pompe débitant
quelque 250 l/h à vide (sans perte de charge). La vitesse de filtration,
comme pour une filtration biologique, doit être très lente
et ne devrait pas excéder 10 m/h! Cette dernière condition
est difficile à respecter en aquarium, mais, du fait que l'eau
y circule généralement en circuit fermé, ces valeurs
perdent leur signification. Toujours est-il que l'épuration sera
d'autant meilleure que l'écoulement de l'eau à travers le
charbon actif sera lent. Le mieux consiste par conséquent à
prévoir un système de chicanes afin d'augmenter la longueur
du trajet suivi par l'eau filtrée (cf. schéma).
 |
 |
 |
 |
 |
 |
En usage continu, le charbon perd peu à peu de sa capacité
d'adsorption et surviendra le temps où il faudra procéder
à son renouvellement. En effet, rien ne sert de laisser en place
un matériau qui n'est plus capable d'assumer sa fonction. Bien
sûr, il continuera toujours à servir de support bactérien,
mais beaucoup de matériaux, dont ceux mis en place en amont pour
filtrer l'eau, jouent ce rôle sans présenter de risque de
relargage!
Quand s'aperçoit-on de la saturation du charbon actif (qui, en
l'occurrence, ne l'est plus!)? Tout simplement, lorsqu'il n'est plus à
même de décolorer une eau teintée par du bleu de méthylène.
Nous avons vu en effet que ce composé était particulièrement
bien retenu par le charbon actif et que sa couleur très nette et
caractéristique permet un contrôle visuel aisé. Pour
ce faire, il suffit d'injecter un peu d'eau colorée à l'entrée
du filtre: si elle ressort incolore, le charbon est toujours bon pour
le service! Il convient de pratiquer cet essai régulièrement:
vous n' "userez" pas votre charbon!
La régénération n'est malheureusement pas envisageable
par l'aquariophile, fût-il professionnel: elle peut être chimique,
thermique ou mixte, mais nécessite une infrastructure lourde (fours
spéciaux chauffant jusqu'à 900 °C), un protocole délicat
ou des réactifs dangereux.
CONCLUSION
Le charbon actif est un matériau de filtration d'usage très
répandu. Néanmoins, beaucoup d'entre nous l'utilisent sans
connaître ses qualités réelles. Cet article vous a
présenté des résultats inédits dont se dégagent
les grandes lignes suivantes:
- l'adsorption des matières minérales, telles les nitrites
ou les nitrates, est tellement réduite que le charbon semble difficilement
pouvoir apporter une solution réaliste!
- l'adsorption des métaux est relative en cas de pollution, mais
constitue, plus généralement, un inconvénient car
il éliminera le principe actif d'un médicament (le sulfate
de cuivre ou le permanganate de potassium) ou d'un engrais (le sulfate
de fer).
- l'action catalytique contre l'excès de chlore est indéniable.
- l'adsorption des matières organiques est très importante.
Ceci appelle la réflexion suivante: le charbon actif, s'il n'est
en aucun cas la panacée, a-t-il même un intérêt
en aquariophilie?
Les aquariophiles qui l'utilisent pour ôter le chlore ont tout-à-fait
raison, mais sont-ils nombreux à le faire pour cette raison? Ceux
qui l'utilisent pour une simple filtration physique de l'eau ne sont sans
doute pas déçus (sa grande porosité en fait un subtrat
de choix), mais sont sûrement fortunés car d'autres matériaux
moins dispencieux et tout aussi efficaces existent: mousse synthétique,
sable, lave, etc. Ceux qui l'utilisent pour lutter contre une pollution
organique le font à bon escient puisque son action est remarquable.
Enfin, ceux qui en usent dans l'espoir d'éliminer les nitrites
ou les nitrates se fourvoient: il est quasiment inopérant!
Il ressort de tout ceci que le seul intérêt pratique de la
filtration sur charbon actif se résume à sa capacité
d'élimination du chlore (qui est rarement généré
dans l'aquarium ...) et des matières organiques (dont les substances
dangereuses, comme les pesticides, n'ont guère de chance d'apparaître
sous la simple action du temps qui passe!). Le premier cas est trop particulier
pour qu'on puisse recommander l'utilisàtion systématique
du charbon actif, d'autant qu'existe une solution simplissime: laisser
reposer l'eau plusieurs heures, voire quelques jours, ou l'aérer:
le chlore dégaze alors; le second prête à discussions:
s'il est vrai que l'eau ne risque pas de s'enrichir en substances organiques
nocives (les tannins, par exemple, ne sont pas toxiques), elle peut en
renfermer au départ (méfiez-vous des eaux prélevées
dans la nature et des eaux de pluie!) et, surtout, certaines molécules
organiques, les protéines et ses produits de dégradation,
constituent les précurseurs des substances les plus gênantes
pour l'aquariophile: ammonium, nitrites et nitrates. Cependant, l'adsorption
de ces précurseurs est faible ou pratiquement nulle (urée,
acide urique).
On en revient alors à la remarque déjà formulée:
une utilisation du charbon actif n'est efficace que si elle s'accompagne
d'un contrôle régulier et d'un remplacement du matériau
chaque fois que cela s'avère nécessaire. Doit cependant
s'en ajouter une autre: son utilisation n'est avantageuse que si elle
est entreprise dès le début et, malgré cela, elle
n'empêche pas la concentration en nitrates de s'accroître:
elle ne peut que la ralentir, par rétention partielle de ses précurseurs
ou des nitrates eux-mêmes.
En fait, l'emploi le plus adapté du charbon actif parait être
celui qui consiste à traiter la source même, c'est-à-dire
l'eau avec laquelle on remplit son aquarium (élimination de polluants
éventuels tels le chlore ou les pesticides), ou l'air que l'on
y injecte (élimination des fumées, gaz délétères,
etc.). Une fois cette précaution prise, l'intérêt
est très discutable (délicat euphémisme!) et rien
ne saurait remplacer les changements d'eau. Le problème des nitrates
demeure et nous force à faire appel à d'autres procédés:
ce sera l'objet d'un prochain article. .
Aux yeux de nombreux aquariophiles, le charbon actif est . . . actif!
En fait, il n'est pas toujours efficace et encore moins indispensable!
Connaître ses limites permet d'en user au mieux.
Remerciements:
la plupart des analyses nécessaires à l'élaboration
de cet article ont été réalisées grâce
à l'infrastructure hautement spécialisée du Laboratoire
Régional d'Alsace d'Analyse des Eaux: que son directeur, M. A.
Exinger, trouve ici l'expression de mes plus vifs remerciements.
 LE CHARBON
ACTIF
LE CHARBON
ACTIF










