 Aux Fers !
Aux Fers !
Oligo-éléments dans l'aquarium
par Renaud LAVIGNE. (Revue Aquarama, 1995)
Le fer est un oligo-élément dont la supplémentation
est fréquemment conseillée en aquaculture. Subsistent néanmoins
des doutes quant à la justesse des renseignements communiqués
au travers des publications.
Cet article s'efforce de clarifier certains points.
LE FER ET LES VEGETAUX
Macro- et micro-nutriments :
La vie des végétaux, comme celle des animaux et des organismes
inférieurs (protistes), nécessite de nombreuses conditions,
dont la disponibilité d'éléments nutritifs. Parmi
ceux-ci, selon la quantité exigée, seront distingués
les macro-éléments des micro-éléments, encore
appelés oligo-éléments (du grec oligoi = peu).
Les macro-éléments sont présents dans les organismes
à des teneurs supérieures à 0,1 % et sont essentiellement
représentés par l'azote (N), le potassium (K), le calcium
(Ca), le magnésium (Mg), le soufre (S), le phosphore (P), le sodium
(Na) et le chlore (Cl).
Les micro-éléments sont présents à des teneurs
parfois très faibles, dites traces ou ultra-traces, s'échelonnant
entre 10-3 et 10-9 soit 0,1 à 0,0000001 % ! Ainsi du fer (Fe) ou
du manganèse (Mn) : 0,1 à 0,01 % ; du zinc (Zn), du cuivre
(Cu) ou du bore (B) : environ 0,001 % ; de l'aluminium (AI), du nickel
(Ni), du cobalt (Co), du molybdène (Mo) de l'iode (I), du brome
(Br) ou du fluor (F) : 0,00001 à 0,00000001 % ; mais également
du lithium (Li), du plomb (Pb), du titane (Ti), du rubidium (Rb), du césium
(Cs), du chrome (Cr), de l'argent (Ag), du cuivre (Cu) ou de l'arsenic
(As), en proportions souvent plus infimes encore...
Malgré leur faible concentration dans les organismes vivants, l'importance
de ces oligo-éléments est considérable. Pour la plupart,
ils participent activement au bon fonctionnement de la "machinerie
vivante", à tel point que le terme d'oligo-élément,
qui, dans son acception primordiale se référait uniquement
à une caractéristique quantitative, est devenu, en outre,
synonyme d'indispensable.
 |
| La Pyrite, ici à cristaux octaédriques, appelée "or des fous" en raison de sa densité élevée et de sa couleur dorée, est un des principaux minerais de fer. |
Le rôle du fer
Parmi ces oligo-éléments, le fer joue un rôle primordial
de transporteur d'oxygène chez les animaux - au travers de l'hémoglobine
du sang mais aussi des chlorocruorines et hémérythrines
-, desquels il permet ainsi rien de moins que la vie ! Il assure le même
rôle chez les végétaux, dont certains renferment des
léghémoglobines (légumineuses) ou même de l'hémoglobine
(certains arbres tropicaux) ! Toutefois, c'est son rôle irremplaçable
lors de la synthèse de la chlorophylle, qui le rend vital pour
les végétaux chlorophylliens.
Le fer doit cette activité à sa propriété
de pouvoir passer facilement, et de façon totalement réversible,
d'une forme doublement oxydée - ou ferreuse, notée Fe2+
ou FeII - à une forme triplement oxydée- ou ferrique,
notée Fe3+ ou FeIII - dont la rouille constitue
le représentant le plus illustre. Chacun sait, surtout lorsqu'il
faut dégripper ou astiquer, que de nombreux métaux s'oxydent
facilement ; il n'y a guère que l'or et, surtout, le platine qui
sont de ce point de vue très résistants (d'où leur
qualificatif de "nobles").
 |
| En milieu oxygéné humide, ce qui est le cas d'un aquarium, le fer s'oxyde rapidement en formant de la rouille, composé ferrique très peu soluble dans l'eau. |
La répartition quantitative de ces formes est sous la dépendance
du potentiel rédox notamment. Il en existe d'ailleurs d'autres
telles les ferrites ou les ferrates, mais elles ne présentent aucun
intérêt en ce qui nous concerne. En présence d'eau
(l'humidité de l'air suffit) et d'oxygène - qui est un oxydant
-, le fer est oxydé et apparaît la rouille (cf. photographies)
dont la couleur est caractéristique de l'ion ferrique.
Ceci constitue la preuve que les ions ferreux - de couleur vert pâle
- et le fer non oxydé (Fe) ne sont pas stables dans les conditions
normales d'un aquarium, milieu humide s'il en est...
Petite digression à ce propos : l'écotoxicologie des pluies
acides viendrait en partie de l'interférence de l'aluminium sur
le métabolisme du fer : la diminution du pH des eaux accroît
en effet la solubilisation de l'aluminium (les métaux sont généralement
attaqués par les acides) et, ce métal, contrairement au
fer, n'a pas la possibilité d'être doublement oxydé
; par conséquent, après qu'il a été absorbé,
il s'ensuit un blocage des réactions biochimiques et la mort cellulaire
!
Ainsi, dans les Vosges, il a été établi une corrélation
très nette entre le pH, la concentration en aluminium et l'occurrence
des truites présentes (lorsqu'il en subsistait !) A ce titre, les
pêcheurs et les chasseurs, tout comme les aquariophiles, et aussi
paradoxal que cela puisse paraître, sont d'ardents défenseurs
de la Nature car ils sont à même de constater les atteintes
portées à l'environnement et d'en subir les désagréments...
 |
 |
| Le sulfate ferreux est un des composés du fer les plus courants. | Le chlorure ferrique est généralement utilisé comme source d'oligo-élément. |
Les carences en fer
D'autres causes que la présence d'aluminium sont susceptibles d'induire
une carence en fer. On dit qu'il y a carence, ou déficience, lorsqu'un
composé est présent à une concentration inférieure
à la concentration suffisante pour l'organisme, ce qui revient
à dire que ce composé est alors facteur limitant (loi de
Liebig).
Par contre, au-delà de la concentration optimale, il y a toxicité,
et ce, quel que soit le composé considéré : ce n'est
qu'une question de dose : "Toutes les substances sont toxiques ;
aucune n'est atoxique.
Seule la dose fait qu'une substance n'est pas toxique" (Th. Bombastus
von Hohenheim, dit Paracelse). Ainsi, comme il ne faut qu'environ 1 g
de cyanures ou 0,1 g de nicotine pour tuer un homme, on les qualifie de
toxiques. Quant à la toxine tétanique, il suffit de 0,00000001
g pour produire le même effet !
Mais que dire du vulgaire sel de cuisine ?
Atoxique ? Que nenni ! Avalez-en 1 kg et vous aurez toute chance, si l'on
peut dire, de ne plus jamais pouvoir recommencer ! Et l'on découvre
qu'il y a considérablement plus de différence de toxicité
entre la toxine tétanique et le cyanure (quelque cent millions),
qu'entre le cyanure et le sel (mille)... Mitscherlich, en 1909, a décrit
cet effet de la concentration sur la croissance des végétaux
(cf. graphe).
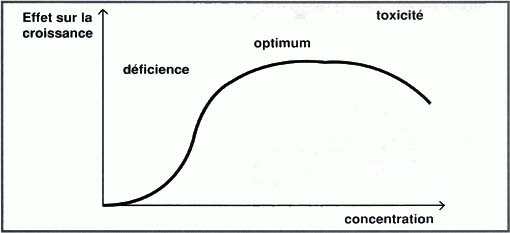 |
| Graphe : Effet de la concentration en un élément sur la croissance du végétal. |
La carence en fer peut être induite par :
- une trop faible quantité de fer dans le milieu (carence vraie)
: Exemple : si l'acidité diminue, le fer est hydrolysé et
précipite sous forme d'hydroxydes fortement insolubles, d'où
diminution de la biodisponibilité.
- un défaut de métabolisation du fer (carence induite) :
Exemple 1 : de fortes concentrations en calcium (Ca) ou manganèse
(Mn) entraînent une modification de la perméabilité
de la membrane cellulaire, ce qui engendre une baisse de l'assimilation
du fer par antagonisme (le phénomène concerne essentiellement
le soufre, le potassium, le magnésium et le fer).
Exemple 2 : il y a assimilation compétitive entre l'aluminium et
le fer, phénomène valable également entre le potassium
et le rubidium, le chlore et le brome, le brome et l'iode, le sulfate
et le sélénate, etc.
En aquarium, la carence en fer résulte fréquemment d'un
adoucissement de l'eau (carence vraie) ou, inversement, de sa grande dureté
(antagonisme du calcium). Cette carence se manifeste chez les végétaux
par une chlorose (du grec khlôros qui signifie vert), maladie se
traduisant par une décoloration du limbe : les feuilles deviennent
jaunâtres, conséquence de l'arrêt de la synthèse
de la chlorophylle, et les fonctions vitales du végétal
sont alors atteintes.
Le fer et la floraison
Si le fer permet la croissance des végétaux, il facilite
également la floraison des... inepties!
Beaucoup de " fausses vérités " circulent dans
la littérature aquariophile, et je crois bon de mettre un peu d'ordre
dans ce capharnaüm.
Le lieu:
Dans la plante, comme dans le poisson, le fer représente de l'ordre
de 0,01 % de la masse. Si le poisson le tire de son alimentation, la plante
l'extrait du sol ou de l'eau.
Déjà surgit une confusion à ce niveau: les plantes
aquatiques puisent directement dans l'eau par les hydropodes, généralement
situés sur les feuilles, alors que les plantes terrestres assimilent
par les racines à partir de la " solution de sol ". Que
certaines plantes aquatiques, telles les cératos (Ceratophyllum
sp.), soient dépourvues de racines, constitue une preuve de
l'absorption foliaire.
Le problème est que beaucoup de plantes d'aquarium ne sont pas
des plantes aquatiques mais des plantes palustres, leur commercialisation
faisant florès depuis quelques années. Une astuce pour reconnaître
les plantes aquatiques vraies consiste à les sortir de l'eau (cf.
fig 1): si les tiges s'affaissent, la plante a toute chance d'être
aquatique, alors que si elles demeurent dressées, elle est vraisemblablement
paludéenne ou, pire!, terrestre.
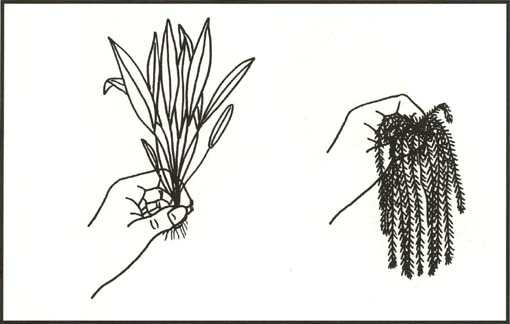 |
| Comment reconnaître une vraie plante aquatique ? La plante palustre émergée reste dressée (à gauche) ; la plante aquatique émergée pend (à droite). |
Ceci a pour corollaire qu'il faudrait, a priori, enrichir et le sol et
l'eau, afin que toutes en profitent. En fait, enrichir l'eau revient à
enrichir le sol, du seul fait de la circulation d'eau - donc de la dissémination
des éléments dissous - jusque dans le sol; et enrichir le
sol finit par enrichir l'eau, si tant est que les nutriments soient solubles.
Foin donc des querelles pour savoir s'il faut enrichir plutôt le
sol ou l'eau. La commodité voudrait que l'on enrichissât
l'eau, cette procédure assurant en outre une meilleure homogénéisation
(ce qui peut toutefois s'avérer un inconvénient si l'on
souhaite favoriser la croissance de certaines plantes seulement).
La dose:
Un point de départ sensé consiste à mimer les concentrations
naturelles: cela peut sembler évident, mais l'évidence n'est
apparemment pas coutumière de tout le monde si l'on en juge par
les doses préconisées par certains...
Malheureusement, il est dommage que peu d'analyses complètes soient
disponibles, car certains paramètres, pas seulement le fer, permettraient
de mieux connaître, et donc reconstituer, les milieux exotiques.
Ainsi de la turbidité ou de la couleur, forcément très
variables selon le régime pluviométrique, mais qui renseignent
presque idéalement de l'aspect de l'eau; idem de la teneur en silice
et en fer (latérite), en tannins (eaux noires) ou en MES (eaux
blanches).
 |
| Le fer est responsable de la belle couleur verte des végétaux et sa carence se manifeste par une décoloration de la plante, quelle soit aquatique, paludéenne (ici Ophiopogon) ou terrestre. |
A côté des sempiternels TH et TAC, pourquoi omettre les autres
éléments majeurs (potassium, sodium, calcium, magnésium,
chlorures, sulfates, nitrates) ainsi que certains autres paramètres particulièrement
dignes d'intérêt, dont le fer? La fiabilité des résultats ainsi obtenus
in situ est évidemment sujette à caution, car existent de nombreux aléas:
représentativités spatiale et temporelle de l'échantillon, échantillonnage,
conservation et analyse! Autant dire que les données que nous avons, même
obtenues selon les règles de l'art, ne sont bien souvent qu'indicatives.
Néanmoins, en ce qui concerne le fer, nous serions déjà bien heureux de
posséder de telles indications, aussi indicatives fussent-elles... En
effet, il n'existe guère de données et en voici compilées quelques -unes
:
 |
Les valeurs varient entre 0 et 1300 µg/I, avec un mode et une moyenne de l'ordre de 100 µg/I. Outre cette démarche, somme toute naturelle - c'est le cas de le dire -, on peut imaginer procéder selon une démarche qualifiée de synthétique, et qui consiste à essayer de définir, par tâtonnements, un milieu de culture idéal. Pour ce faire, on fait varier les concentrations des différents nutriments et on observe, en les quantifiant éventuellement, les effets sur la croissance des végétaux. C'est ainsi qu'ont été formulés des dizaines de milieux de culture dont celui de Knop, l'un des plus anciens et des plus simples, est sans doute le plus connu. Les engrais aquatiques n'échappent pas à la règle et contiennent du fer sous une forme ou sous une autre (Sera Florena, Sera Florenette, Tetra Flora Pride, etc). De nombreuses formulations modernes existent et sont plus ou moins spécifiques: l'une pour la culture des méristèmes, l'autre pour les plantes à fleurs, telle troisième pour les légumes... En ce qui concerne les végétaux aquatiques, le tableau suivant présente les teneurs en fer de quelques milieux de culture (Hormis HW, fabricant bien connu, les organismes cités comme sources sont des organismes certificateurs ou normalisateurs nationaux ou internationaux):
 |
Si les valeurs oscillent moins que les teneurs en milieux naturels, la
moyenne reste comparable puisque l'ensemble converge assez nettement vers
une concentration d'environ 100 µg/I. Ce préambule nous amène à
passer en revue les valeurs recommandées par divers auteurs aquariophiles:
 |
La comparaison de toutes ces valeurs met en évidence une discordance marquée
et il semblerait qu'il y eût une erreur d'unité sur la première d'entre-elles.
Qui plus est, les limites d'intervention prônées sont, non seulement différentes,
mais parfois contraires! Ainsi, R. Allgayer conseille un apport si la
concentration est inférieure à 2 mg/I, alors que H. Hiéronimus recommande
une concentration totale n'excèdant pas 1,5 mg/I! Le tableau qui suit
résume les données précédentes:
 |
Hormis la valeur citée par R. Allgayer, l'ensemble est donc cohérent
et les milieux synthétiques, volontairement enrichis en oligo-éléments
dont le fer, sont plus conformes à la réalité que
l'on pouvait craindre.
Il semble par conséquent que la concentration réaliste se
situe aux alentours de 100 µg/I. Rappelons qu'une teneur excessive
en fer est susceptible d'entraver les échanges respiratoires des
poissons par précipitation de la rouille sur les branchies.
La forme:
Le fer est un constituant très abondant sur Terre, dont on a de
bonnes raisons de penser que la graine et le noyau - qui constituent le
coeur de la planète - sont en grande partie constitués de
fer. S'il existe des centaines de minéraux renfermant du fer, de
l'actinote à la zinnwaldite, en passant par l'hématite (oxyde)
et la pyrite (sulfure), le fer ne se retrouve dissous dans l'eau que sous
deux formes principales: le fer ferreux et le fer ferrique.
 |
| En présence d'EDTA, le fer ferreux (vert pâle) s'oxyde en fer ferrique (orangé). Les concentrations sont de 4 mM. |
Les sels ferreux étant vert pâle et les sels ferriques étant
orangés, la couleur des roches renseigne des conditions paléoclimatologiques
lors de leur formation: une roche de couleur rouille est caractéristique
d'un milieu oxydant, donc d'une atmosphère riche en oxygène. C'est ainsi
qu'on a pu déterminer l'évolution de la teneur en oxygène
de l'atmosphère au cours des temps (celui-ci étant initialement
absent et n'étant dû qu'à l'activité photosynthétique
des végétaux!).
Le fer, ferreux ou ferrique, peut éventuellement être intégré
dans des molécules organiques, comme l'hémoglobine - et
l'on parle alors de composés organiques du fer ou, en raccourci,
de fer organique - ou être chélaté, par des tannins
par exemple, et l'on parle alors de fer complexé. Là aussi,
les avis divergent, ou, plus exactement, convergent vers l'erreur! En
effet, pratiquement tous les auteurs conseillent l'ajout de fer ferreux
et vont jusqu'à prétendre que l'utilisation de fer ferrique
ne sert à rien.
Ainsi H. Hiéronimus écrit que le fer ferreux est le seul
soluble, ce qui est faux; il poursuit en indiquant une réduction
du fer en composés ferreux (FeII), ferriques (Fe3+
et ferrates (Fel ce qui est quadruplement erroné, puisqu'il s'agit
d'une oxydation et non d'une réduction et que le ferrate est une
forme sextuple-ment oxydée et non quadruple-ment!
R. Allgayer, cité par D. Biellmann, dit que seuls les sels ferreux
conviennent mais qu'ils sont peu solubles, ce qui est donc en contradiction
avec les propos précédents! Mettons un peu d'ordre dans
cet imbroglio...
Les sels ferriques peuvent être plus solubles que les sels ferreux, aussi
bien en masse qu'en quantité de matière, comme on peut en juger d'après
le tableau que voici (d'après Weast, R. C. (1982). Handbook of chemistry
& physic, CRC Press):
 |
Ceci étant, la solubilité est fonction des conditions physico-chimiques
du milieu, notamment du pH et du potentiel rédox. Les ions ferreux
et ferriques en particulier ne sont solubles que dans des eaux acides:
dans les eaux alcalines, ils précipitent sous forme d'hydroxydes.
Si la solubilité n'est donc pas un critère valable pour
privilégier les sels ferreux par rapport aux sels ferriques, peut-être
une préférence par les végétaux justifie-t-elle
ce choix? Las! Aucun des biologistes que j'ai contacté n'a connaissance
du fait. Pire: sur 8 formules de milieux synthétiques utilisés
pour la culture des algues à l'heure actuelle de par le monde par
les scientifiques - qui ne sont pas tous enclins à entreprendre
des expériences vouées à l'échec! -,... 8
utilisent les sels ferriques!
 |
| Les déminéralisateurs ou osmoseurs produisent une eau fortement carencée en oligo-éléments (et en macro-éléments). L'eau ne peut alors être utilisée pure. |
C'est ici que l'on retrouve la confusion fréquente entre le fer
assimilable et le fer soluble. La forme la plus soluble n'est pas forcément
la plus assimilable et réciproquement. Pour s'en convaincre, il
suffit de savoir que le fer héminique (du sang) présent
dans la viande nous est bien plus assimilable que le fer que l'on retrouve
dans l'eau ou les épinards!
Sont en effet impliqués des phénomènes - que je ne
détaillerai pas - de transports passifs ou actifs, avec l'intervention
de molécules telles les ionophores qui jouent le rôle de
" convoyeur " de molécule ou d'ions afin d'en faciliter
l'assimilation.
Dernier argument de choc contre les thuriféraires du fer ferreux:
toutes ces personnes utilisent - sans le savoir, bien entendu! - du fer
ferrique!! Ceci m'amène au développement suivant...
L'emballage:
L'emballage est constitué par des molécules permettant de
favoriser l'assimilation du fer en le maintenant en solution. Cela revient
à dire qu'on augmente la solubilité de l'ion.
Ces molécules, appelées complexants ou chélatants,
ont une si forte affinité pour certains ions qu'elles forment spontanément
avec eux une molécule complexe, le chélate, très
stable, ce qui permet à l'ion d'être " abrité
"; il est ainsi soustrait de l'action hydrolytique qui conduirait
à sa précipitation ou à son adsorption sur le charbon
actif (cf. Aquarama n°123, 1992, p 46). Est généralement
cité l'EDTA (Acide Ethylène Diamine Tétraacétique),
mais il existe quantité de chélatants naturels, tels l'acide
citrique et les tannins, ou synthétiques, tels l'EDDHA (Ethylene
Diamine Diortho Hydrophenyl Acid), le DTPA (Diethylene Triamine Pentaacetic
Acid), l'EGTA (Ethylene Glycol bis [2-aminoethylether] Tetraacetic Acid)
ou le DCTA (1,2-Diamino Cyclohexane Tetraacetic Acid)! Sans compter les
récents cryptates qui sont des molécules en forme de cage
dont la découverte - ou plus exactement l'invention - a valu le
prix Nobel au chimiste français J.-M. Lehn en 1987.
Inventorions, une fois encore, les confusions de la littérature:
R. Allgayer est convaincu que le magnésium et le calcium sont chélaté
en dernier. Le simple bon sens montre que si cela était, une eau titrant
10 °f de dureté totale - ce qui n'est pas beaucoup - nécessiterait
l'adjonction de près de 400 mg d'EDTA par litre, rien que pour complexer
le calcium et le magnésium!
Qu'on se le dise: l'EDTA complexe le fer avant les autres métaux,
le calcium et le magnésium étant parmi les métaux
qui sont le plus faiblement chélaté! Le tableau suivant
permet de s'en assurer (plus la valeur est élevée, plus
l'ion est fortement complexé par l'EDTA):
 |
De ces chiffres, les chimistes déduisent facilement que le fer, qu'il soit ferreux ou ferrique, a beaucoup plus d'affinité pour l'EDTA que le calcium et le magnésium.
R. Allgayer attire l'attention sur le fait que l'excès d'EDTA peut entraîner un glissement d'oligo-éléments. On remarquera au passage la contradiction avec le propos antérieur, puisque le fer était censé n'être complexé qu'en dernier et l'EDTA ajouté en quantité très inférieure à la quantité qu'il eût fallu utiliser pour complexer les seuls calcium et magnésium présents dans l'eau!
Cette assertion n'est toutefois pas dénuée de justesse, mais c'est précisément parce que le fer et les autres oligo-éléments sont complexés avant le calcium et le magnésium que ce risque existe! La conséquence en est qu'il faut respecter la proportion entre le fer et l'EDTA comme l'a dit Allgayer et rappelé Biellmann.
On se reportera au tableau pour déterminer les masses nécessaires de chacun des composés, sachant qu'il faut quelque 750 µg d'EDTA ou d'un de ses dérivés et environ 350 µg d'un sel de fer pour un litre d'eau; la proportion massique approximative entre les deux est donc de 2.
Voici, pour vous aider, deux tableaux récapitulant les masses à utiliser en fonction des produits disponibles, de façon à obtenir une solution finale de 2 µM de fer chélaté, soit quelque 100 µg/l:
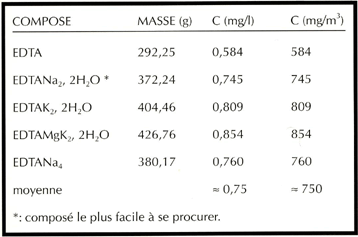 |
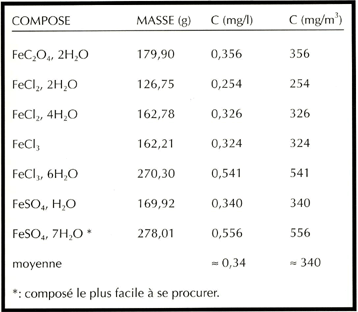 |
Tous les auteurs recommandent, voire imposent, la forme disodique de
l'EDTA. Ce conseil est judicieux mais n'a rien d'impératif: on
peut fort bien faire usage de la forme dipotassique ou d'une autre (cf.
photographies). Il se trouve simplement que le sel disodique est facilement
soluble, mais le sodium, pas plus que le potassium, n'interviennent dans
la complexation!
Hiéronimus voit en l'EDTA un agent antioxydant qui protégerait
le fer, ce qui est doublement faux: d'une part, le fer non oxydé
n'est pas assimilable; d'autre part, l'EDTA accélère l'oxydation
du fer! Je l'ai démontré (la démonstration n'étant
compréhensible que des seuls chimistes, je vous en fait grâce)
puis vérifié de visu, ce que chacun peut faire, comme en
témoignent les photographies illustrant cet article. Si l'on se
réfère au tableau précédent, on constate que
l'affinité du FeIII est la plus forte de toutes (29,1)
et, en particulier, par rapport à FeII (14,3); on conçoit
dès lors que l'EDTA ait tendance à transformer FeII
en FeIII avec qui il est plus stable. Pour vous donner une
idée, l'expression des chiffres étant trompeuse, sachez
que l'affinité de l'EDTA pour FeIII n'est pas le double
de celle pour FeII, mais d'un million de milliard de fois plus
importante!
De l'équation chimique, il ressort que l'ajout d'EDTA à une solution de
FeII conduit à la formation de FeIII et que
cette réaction est très favorisée: à l'équilibre,
il reste 1 ion de FeII pour plusieurs billions de billions
de tonnes de complexe [EDTA-FeIII], c'est-à-dire, de
façon plus concevable, équivalant à un seul atome
dans une étoile!
Cette preuve constitue l'argument "massue" que j'évoquais
précédemment: ceux qui porte au pinacle l'EDTA sont les
mêmes qui vitupèrent contre l'emploi de FeIII
et prônent l'utilisation de FeII. Tout serait bel et
bon si l'EDTA ne transformait pas le second en premier...
La conclusion est évidemment que l'on peut utiliser aussi bien
les sels ferreux (par exemple, le sulfate) que ferriques (par exemple,
le chlorure): cela n'a strictement aucune importance!
Si ce fait, qui, à ma connaissance, n'a jamais été
relaté dans la littérature, avait été connu,
bien des confusions n'eussent jamais été commises ni perpétrées.
Des expériences en cours me permettront, je l'espère, de
comparer les mérites respectifs de différents chélatants
et de proposer une formule d'engrais d'une haute efficacité biologique.
Il vous faudra néanmoins patienter quelque peu car il y a fort
à... fer.
| A propos du courrier
des lecteurs (M.J.-L. R. de Chambly), j'aimerais compléter
le propos très juste de D. Biellmann: l'eau utilisée
doit contenir des nitrates, si tant est que, d'une part, les concentrations
et volumes cités par le lecteur soient justes et que, d'autre
part, l'augmentation des nitrates durant les 5 jours soit négligeable
- ce que l'on peut supposer sans grand risque de se tromper, sinon
la concentration eût atteint des valeurs considérables! Dans ce cas, si l'eau du robinet était dénuée de nitrates, la concentration résiduelle après 5 changements du tiers serait de 13 mg/I. Etant de 25, on peut en déduire une teneur en nitrates de l'eau utilisée égale à quelque 14 mg/I, ce qui est plutôt dans la bonne moyenne pour une eau d'adduction. Concernant la baisse du pH, je ne pense pas que la douceur de l'eau soit en cause car, normalement, c'est de l'eau déminéralisée que l'on utilise pour préparer de l'eau de mer synthétique et il serait difficile que l'eau du robinet fût plus douce que celle-ci. Peut-être faut-il incriminer une population ou un nourrissage importants, d'où production d'acide carbonique et organiques, ou alors, un " pompage " des bicarbonates/carbonates par assimilation (invertébrés) ou précipitation (substrat). Ceci étant, le problème est sans doute le plus courant en eau de mer et je ne sais si " un aquariophile marin " y a jamais échappé! |
