 SABLE DE FORAMINIFERES
(Biofora)
SABLE DE FORAMINIFERES
(Biofora)
Un nouveau matériau filtrant et substrat pour aquariums marins
par P. WILKENS (Aquarama - 1982) / adapté par R. MARBE
Les matériaux de filtration sont un sujet de discussion fréquent lors
de réunions d'aquariophiles. Souvent les esprits s'échauffent, car les
méthodes de filtration sont si variées et les promesses faites si éloquentes
qu'il est pratiquement impossible de se faire une idée d'ensemble.
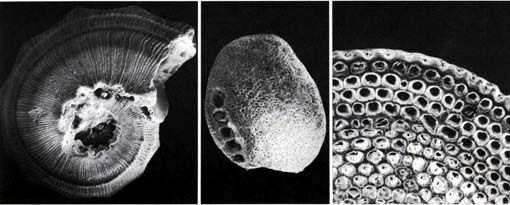 |
| Sable de foraminifères - "Biofora". Forme et structure spatiale d'une coquille individuelle avec les fins pores. Photos (microscope électronique a trame): Schumacher et Plewka |
Lors d'une conférence. Monsieur WENZEK du Corallen Center à
Velbert me montra un nouveau sable de corail dont la structure me fascina.
Il se composait essentiellement de grains pratiquement ronds, de couleur
jaune très clair et de 1 à 3 mm de diamètre. Le poids
très faible de ce sable m'impressionna tout particulièrement.
Un courant d'eau même léger fait rouler les grains de surface
de-ci, de-là.
A la recherche de possibilités nouvelles pour améliorer
le milieu marin en aquarium, comme tous les aquariophiles d'eau de mer,
j'étais tout à fait disposé à entreprendre
une série de tests biologiques avec ce "sable"
nouveau. Tout d'abord, il m'importait cependant de savoir ce qu'il en
était vraiment de ces grains. Une étude de l'Université
de Bochum m'apporta la réponse : le Dr H. SCHUMACHER, auteur de
l'ouvrage remarquable "Récifs coralliens", et son collaborateur
M. PLEWKA. ont établi que les grains de ce sable étaient
les coquilles de foraminifères Calcarina et Amphiserus.
Ils réussirent également une photo exceptionnelle grâce
à un microscope électronique à trame. Ce cliché
révèlait très bien la forme et particulièrement
la structure spatiale d'une coquille avec les fines pores.
Les foraminifères forment en tant que Foraminifera un groupe purement
marin de la classe des Rhizopode. Ces unicellulaires du sous-règne
des protozoaires sécrètent des coquilles de formes très
diverses d'une substance de base organique additionnée de chaux
(carbonate de calcium) et chez certaines espèces aussi de dioxyde
de silicium. De nombreuses espèces sont bien conservées
en tant que fossiles et jouent un rôle très grand dans la
recherche géologique. Ils ont encore aujourd'hui une importance
primordiale pour la formation de sédiments dans la mer. Les coquilles
de foraminifères Globigerina recouvrent ainsi presque 50%
des fonds marins.
Comme le nom allemand "Kammerlinge" - l'indique (Kammer = chambre),
beaucoup d'espèces forment des coquilles à plusieurs chambres
qui atteignent parfois une taille considérable. On trouve ainsi
des coquilles qui ne font que des fractions de millimètre jusqu'à
des géants d'une taille de cinq à dix centimètres.
Pour un unicellulaire il s'agit là d'un effort admirable quand
à la sécrétion calcaire.
Aussi diverses et bizarres que puissent être les coquilles des différentes
espèces, elles sont toutes percées de pores très
fins incalculables. C'est par eux que l'animal vivant sort ses rhizopodes
qui forment une toile très fine permettant de retenir les proies.
Les foraminifères vivent principalement au sol. Seuls quelques-uns
comme les Globigerinidae sont des organismes planctoniques. Ce qui m'intéressa
tout d'abord avec ce sable de foraminifères, c'était son
effet tampon, c'est-à-dire était-il capable de maintenir
la capacité tampon de l'eau de mer sur une longue période
et ainsi une valeur élevée et régulière du
pH supérieure à 8. J'équipais deux aquariums en verre
de 50 litres d'un simple filtre de fond et recouvris la plaque du filtre
dans un bac avec 2 kg de sable de quartz exempt de calcaire d'une granulation
de 1 à 3 mm, et dans l'autre avec 2 kg de sable de foraminifères.
Les deux aquariums ont été remplis avec de l'eau de mer
maturée et peuplés chacun avec 30 guppys acclimatés
à l'eau de mer. Les poissons ont reçu pendant une période
de quatre mois exactement la même quantité de nourriture
sèche pour poissons d'aquariums. La valeur du pH et la dureté
carbonatée, qui révèle la capacité tampon
de l'eau de mer, ont été relevés régulièrement.
Au début de l'expérience, la valeur du pH était de
8,2 à 8,3 dans les deux aquariums, la dureté carbonatée
étant de 16° dH(*). Après un mois déjà,
la dureté carbonatée dans le premier bac avec du sable de
quartz était tombée à 10° dH, dans le second
elle était à 15,6° dH. Le pH était jusqu'alors
inchangé. Au début du troisième mois, la dureté
carbonatée dans le bac 1 n'était plus que 4° dH, dans
le bac 2 elle se situait à 14,8. Le pH dans le bac 1 était
tombé à 7,9 - 8. Dans le bac 2 il était constant
entre 8,2 et 8,4. A la fin du quatrième mois, la capacité
tampon de l'eau de mer était pratiquement nulle dans le premier
bac, alors que dans le second, elle était toujours de 14,6°
dH. Dans le premier bac, le pH était descendu à 7,7 alors
que dans le second il était toujours entre 8,2 et 8,4. J'avais
donc prouvé gràce à cette expérience très
simple que le sable de foraminifères avait une capacité
tampon exceptionnelle et permettait de maintenir le pH à une valeur
pratiquement constante.
Quel effet ce sable allait-il produire dans un aquarium marin déjà
aménagé ? Pour répondre à cette question,
j'ai petit à petit enlevé tout le fond d'un bac de 300 litres
pour le remplacer par le sable nouveau, soit 30 kg au total. L'épaisseur
de la couche était finalement de 4 à 6 cm. Mis à
part l'aspect extrêmement décoratif, j'ai été
trés surpris de constater après quelques semaines l'absence
de toute nouvelle algue. J'avais été tellement contrarié
iusqu'alors par les pelouses d'algues sur mes fonds de sable de corail
ou d'algogrite qui ne correspondent pas du tout à l'aspect d'un
aquarium reproduisant un récif, que je me réjouis maintenant
de la propreté du sable régulièrement brassé
par le courant d'eau. La croissance de diverses algues supérieures
était fascinante. L'algue Caulerpa prolifera proliférait
réellement dans ce matériau et envoyait des racines blanches
de plusieurs centimètres dans le fond. Les autres espèces
tropicales telles les Caulerpa racemosa, C. sertularoides,
C. macrodisca et C. crassifolia prospéraient également
prodigieusement. Je me réjouis particulièrement de la pousse
d'une algue tropicale Halimeda dont j'avais enterré l'épaisse
racine dans le sable.
Après deux mois. j'entrepris de mesurer le potentiel redox. Je
constatais que les réactions dans le sable étaient toutes
différentes de celles dans l'eau libre. Alors qu'ici le potentiel
redox (électrode platine contre électrode calomel saturé)
se situait entre 300 et 350 millivolts, il n'était que de 150 à
200 millivolts dans le sable. Cette différence est due à
l'activité bactérienne régulière et active,
comparable à un aquarium d'eau douce. Il est bien connu que les
substances organiques sont transformées et largement minéralisées
par l'activité des micro-organismes dans le fond. Il est toutefois
moins connu que ces processus de transformation libèrent des oligo-éléments
métalliques dans une forme assimilable par les plantes, ici les
algues. L'intense activité des micro-organismes dans le fond donne
un potentiel redox légèrement plus bas, ce qui permet aux
plantes d'assimiler les micro-éléments nutritifs très
importants tel le fer, le manganèse et d'autres. Ainsi, j'avais
l'explication de la croissance prodigieuse des algues marines mentionnées
plus haut.
Une autre question qui me préoccupa à ce sujet était
la formation de situations anaérobies, c'est-à-dire pouvait-il
se former des processus de pourriture ? Au terme d'une année, je
puis indubitablement répondre non. Déjà le contrôle
régulier du potentiel redox ne donnait aucune indication de conditions
anaérobiques. Quand j'ai enlevé une partie du sable au bout
d'une année, il n'y avait aucune pourriture, malgré une
hauteur du sable de 6 cm à certains endroits. Le substrat était
jaune clair partout, bien que j'avais soigné et nourri dans cet
aquarium 30 colonies de sarcophytons, gorgones, des anémones actinodiscus,
des coraux, des palythoa ainsi que dix petits poissons. La formation de
détritus était également bien inférieure à
ce que l'on trouve avec du sable à grosse granulation. C'est probablement
dû aussi à l'activité intense des micro-organismes.
Le résultat le plus stupéfiant pour moi fut cependant le
taux de nitrates. Je n'avais effectué aucun changement d'eau pendant
toute l'année (ceci à titre d'essai, normalement, je change
environ 10% par mois, et le taux de nitrates n'avait augmenté que
faiblement d'une valeur initiale de 16 ppm (ppm parts par million) à
une valeur de 28 ppm. Selon mes expériences basées sur des
tests nombreux et avec l'apport important de nourriture, ce taux aurait
dû ètre d'au moins 120 à 150 ppm au bout d'une année.
Comment expliquer une élévation aussi faible ? J'avais déjà
remarqué précédemment que dans certaines circonstances,
telles que l'utilisation de " pierres vivantes " - et une filtration
de longue durée sur charbon actif très absorbant, le taux
de nitrates ne s'élevait que très lentement. Un article
du scientifique nord-américain R.F. VACCARO offrait une explication
à ce phénomène. Selon lui ont lieu des processus
de dénitrification considérables dans tout substrat biologiquement
actif telle qu'une filtration lente sous gravier. Les nitrites comme les
nitrates sont alors biologiquement réduits et il se forme comme
produits finaux de l'oxyde de bi-azoté NO2+1
ainsi que de l'azote moléculaire libre NO2+2.
Ce procédé, appelé aussi respiration de nitrates,
peut être effectué par des groupes bactériens de toutes
sortes. Les micro-organismes appelés dénitrifiants vivent
en partie dans des conditions purement anaérobiques (sans oxygène)
et en partie aérobiques (donc avec oxygène).
Il semblerait que les deux groupes vivent dans le sable de foraminifères.
Quelques parties de sable que je gardais en conditions de manque d'oxygène
développèrent rapidement des populations de bactéries
anaérobies
composées de Pseudomonas, Micrococcus, et Thobiacillus.
Je suppose que ces bactéries vivent à l'intérieur
des coquilles de foraminifères dans des conditions anaérobiques
et y réduisent les nitrates y pénétrant. Le
volume intérieur des coquilles de foraminifères, gigantesque
en comparaison des grains de sable massifs, offre évidemment un
substrat de peuplement idéal. La porosité élevée
et la légèreté du sable permettent simultanément
une bonne aération du fond. ce qui évite, comme je l'ai
mentionné au début, tout processus de pourriture. La minéralisation,
la nitrification et la dénitrification comme parties du cercle
d'azote, semblent se dérouler dans des conditions particulièrement
favorables dans le sable de foraminifères selon mes essais actuels.
A l'heure actuelle, j'effectue encore des expériences avec divers
filtres à sable lents pour déterminer l'utilisation optimale
du matériau. J'en parlerai le temps venu.
En tous cas, le sable de foraminifères est tout particulièrement
adapté comme substrat de fond ainsi que pour la filtration biologique.
Le peuplement en micro-organismes et minifaune marins aussi variés
que possible est très important. Ceci est rendu possible par les
pierres vivantes en provenance des différentes mers et par les
algues.
Back to Top ^
