 Les Nitrates
en aquarium
Les Nitrates
en aquarium
par Renaud LAVIGNE. (Revue Aquarama, 1988)
Photos et dessins de l'auteur
Si l'intérêt de la connaissance du taux de nitrates dans
l'eau est indéniable pour l'aquariophile, celle-ci, comme nous
allons voir, n'est pas aussi facile que bon nombre d'entre nous le souhaiterait.
Mais d'autres solutions s'offrent à nous.
 |
| Un entretien régulier avec changements d'eau fréquents est la meilleure garantie de la bonne santé d'un aquarium. |
I - De l'importance des nitrates en aquariophilie:
1 - Les origines:
Les nitrates sont formés au cours de réactions de salification
à partir de l'acide nitrique (processus chimique) ou lors de réactions
biochimiques de dégradation de la matière organique (processus
biologique), dont on peut considérer qu'ils constituent l'ultime
étape.
C'est ce dernier phénomène qui nous intéresse tout
particulièrement.
Les nitrates sont des ions constitués de 3 atomes d'oxygène
pour 1 atome d'azote (N); leur formule chimique est NO3-.
L'augmentation de leur teneur ne peut donc s'effectuer s'il n'y a un apport
de molécules azotées, ce qui nous conduit à passer
en revue les sources d'azote présentes dans l'eau.
- l'azote d'origine minérale:
Outre l'azote gazeux dissous, dont la concentration approximative de 15
mg/I est due à la dissolution de l'azote atmosphérique (N2),
il peut exister des sels issus de la solubilisation des roches telles
le salpêtre ou de l'entrainement par écoulement d'engrais
chimiques; ce seront notamment des ions ammonium (NH4+)
et nitrate (NO3-). Les autres formes courantes telles
que nitrites (NO2-) ou ammoniac (NH3)
sont principalement originaires de la transformation d'autres molécules
ou de réactions d'équilibre.
Dans les eaux naturelles non polluées, les molécules azotées
d'origine minérale se retrouvent donc en faibles quantités.
Cependant, même les eaux météoriques peuvent en recéler,
ceci faisant suite à l'entrainement par les pluies d'oxydes d'azote
ou d'ammoniac présents dans l'air. Le récent incident survenu
à Nantes en octobre 1987 sert à nous rappeler que l'acide
qui se retrouve dans l'atmosphère peut, après précipitation,
augmenter la concentration en ions dans l'environnement aquatique. Le
phénomène des pluies acides, dont la cause est essentiellement
liée à l'activité humaine (il existe des émissions
de gaz sulfurés lors d'éruptions volcaniques, ce qui engendre
des retombées d'acide sulfurique) est maintenant suffisamment connu
du public.
- l'azote d'origine organique:
L'on distinguera les molécules biologiques, issues du métabolisme
des êtres vivants, telles qu'acides aminés, acides nucléiques,
enzymes, protéines, urée ou vitamines, des molécules
anthropogéniques, issues de la synthèse en laboratoire,
telles qu'amines, amides ou nitriles, et qui sont utilisées par
exemple comme colorants, médicaments ou pesticides.
Dans les eaux naturelles, la majorité, soit environ 35 à
90 %, de l'azote organique est constitué par les substances humiques
et les acides aminés, qui composent les protéines.
Notons pour fixer les idées, que les substances humiques contiennent
2 % d'azote, les chlorophylles 6 %, les acides aminés, de 7 à
32 %. A titre de comparaison, les nitrates en renferment 23 %, les nitrites
30 % et les ions ammonium 78 %.
Dans les eaux naturelles, les principales sources sont donc minérales
(engrais, roches) et organiques (déjections, matières organiques)
et l'on constate généralement des valeurs de 0,2 à
0,5 mg/I d'ions ammonium et de 3 à 20 mg/I de nitrates.
La pollution azotée est caractérisée par une concentration
élevée de ces molécules. Elle est naturelle et acceptable
si elle suit un processus normal, inévitable en l'absence de l'homme;
elle l'est moins si elle est liée à l'activité humaine,
que ce soit à cause des rejets urbains, des rejets industriels
ou des apports agricoles. Dans ce cas, les teneurs peuvent être
fortement accrues, jusqu'à plusieurs dizaines de milligrammes d'ions
nitrate et plusieurs milligrammes d'ions ammonium par litre.
Pour montrer l'interdépendance qui existe entre toutes ces formes,
il est classique de présenter un schéma, le cycle de l'azote:
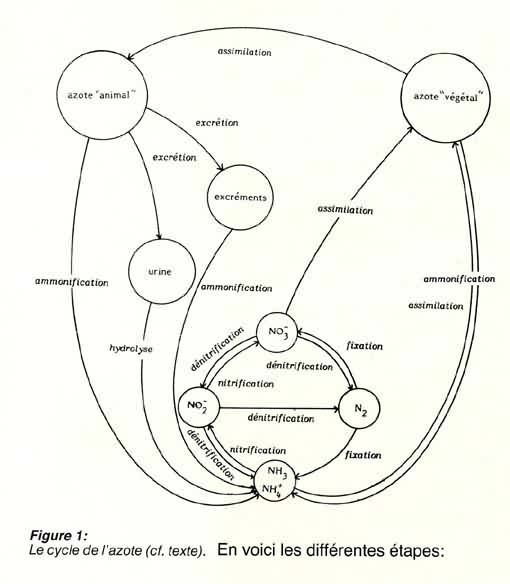 |
- la fixation
L'azote gazeux est transformé en composés minéraux
par les cyanophycées (Anaebaena, Nestoc, Phormidium)
ou les bactéries (Azotobacter, Clostridium Desulfovibrio).
Ce phénomène ne concerne que les organismes très
primitifs.
- l'assimilation:
C'est la transformation en matière organique de composés
minéraux (par les organismes autotrophes c'est-à-dire les
végétaux) ou de matière organique en autre matière
organique (par les hétérotrophes, c'est-à-dire les
animaux). Ce processus constitue ce que l'on nomme synthèse des
protéines. Ainsi, un végétarien transformera les
protéines végétales en protéines animales,
dont les carnivores se nourriront pour fabriquer d'autres protéines.
Seuls les végétaux (dont font partie les bactéries)
sont capables de synthétiser des protéines à partir
d'éléments minéraux; c'est la raison pour laquelle
l'on peut cultiver des plantes grâce à une solution nutritive
ne comportant que des sels minéraux, chose qu'il serait vain d'entreprendre
avec un animal.
- l'excrétion:
Il s'agit de l'émission de matières organiques non assimilées,
car non digestibles, et de molécules plus petites, résultant
de la dégradation plus ou moins complète de la matière
organique, telles que l'ammoniac (amphibiens de forme larvaire, bactéries,
invertébrés et vertébrés aquatiques) l'urée
(amphibiens adultes et vertébrés terrestres) ou l'acide
urique (reptiles terrestres et oiseaux).
- l'ammonification:
Les molécules issues du métabolisme et présentes
dans le milieu après excrétion, sont décomposées
en ammoniac par des bactéries (Achromobacter, Bacillus,
Clostridium, Corynebacterium, Flavobacterium, Nitrococcus,
Proteus, Pseudomonas, Sarratia)
- la nitrification:
C'est la succession de deux processus: la nitritation, qui conduit les
ions ammonium à s'oxyder en nitrites par des bactéries (Nitrosomonas,
Nitrosococcus, Nitrospira) et la nitratation, qui transforme
les nitrites en nitrates par des bactéries également (Nitrobacter).
- la dénitrification:
Processus inverse du précédant, conduisant à la réduction
des nitrates en nitrites puis éventuellement en diazote ou ammoniac
et effectué grâce à des bactéries dénitrifiantes
(Azotobacter, Arthrobacter, Bacillus, Pseudomonas,
Thiobacillus).
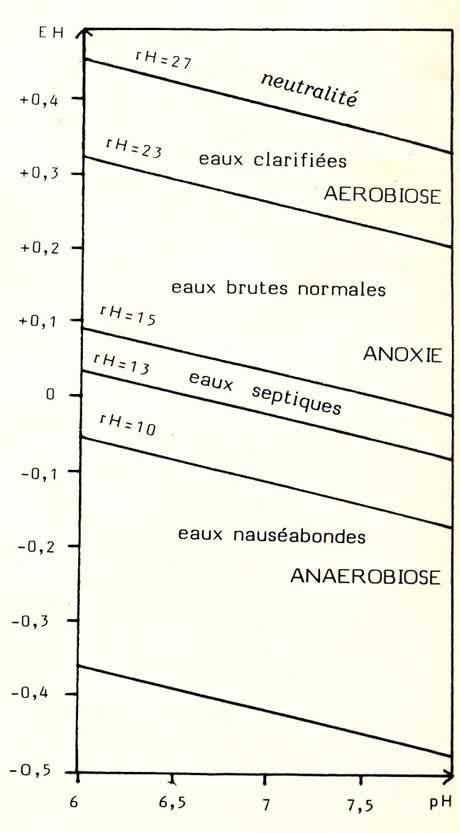 |
| Figure
2: Classification des eaux selon leur potentiel d'oxydo-réduction et leur pH. Plus le rH est élevé, plus les eaux sont biologiquement saines pour la vie évoluée. A la zone la plus inférieure correspondent les phénomènes de putréfaction, avec dégagement de gaz délétères. |
2 - Les effets de l'accumulation des nitrates:
Remarquons que les nitrates sont utiles aux végétaux, qui
contiennent environ 3 % ou plus d'azote, de sorte que tous les engrais
en renferment, tant ceux destinés aux végétaux terrestres
comme le liquide de Knop que ceux pour la culture des végétaux
aquatiques, un milieu usuel de culture des algues en ayant une concentration
de 100 mg/I sous formes de sels de calcium et de potassium.
De plus, les nitrates sont peu toxiques, moins que les nitrites et bien
moins que l'ammoniac, et 100 mg/1 constitue un bon niveau-guide en ce
qui concerne notre hobby, certains poissons d'eau saumâtre résistant
à des teneurs supérieures au gramme par litre.
La lecture du paragraphe précédent laisse entrevoir les
conséquences possibles d'une production excessive de nitrates en
aquarium. Celle-ci étant la dernière étape de la
dégradation des composés azotés, l'on aura une accumulation
de cet ion, ce qui produira une pollution. Cet accroissement de la concentration
participe, conjointement à l'augmentation du taux de phosphates,
au processus d'eutrophisation. Ceci est un phénomène naturel
mais son développement est bien plus rapide en aquarium du fait
qu'il s'agisse d'un milieu fermé et limité. Ce qui se déroule
à l'échelle des ans ou des décennies en milieu naturel,
s'accomplit ici en quelques mois; le viellissement, c'est-à-dire
la dégradation de l'équilibre biologique, est prématuré
et l'aquarium dépérit.
Une augmentation de la D. B. O. (Demande Biochimique en Oxygène)
est entraînée par accumulation de matières organiques,
la production (source de nitrates) en étant généralement
bien supérieure à l'assimilation des nitrates. En effet,
si les végétaux assimilent cet ion, celui-ci est généré
tout à la fois par les excrétions des invertébrés
et des poissons, la nourriture non consommée, éventuellement
les produits chimiques introduits, mais aussi par les débris végétaux!
Qui plus est, un autre phénomène peut se produire, notamment
lorsque les conditions du milieu viennent à décliner, et
qui le rend d'autant plus dangereux, le mal qui était pernicieux
devenant alors fulgurant.
Je veux parler de la dénitrification: celle-ci, qui peut être
chimique ou biochimique, transforme les nitrates accumulés en composés
de plus en plus toxiques (nitrites puis ammoniac). S'il est possible de
maintenir des poissons dans une eau contenant 100 mg/I de NO3-,
voire beaucoup plus, n'espérez pas qu'il en soit ainsi avec une
telle teneur en ammoniac!
En eau de mer, où la faune est plus sensible, le risque est déjà
énorme pour de petites quantités de nitrates, de même
qu'il est supérieur pour les invertébrés.
Comment se produit cette dénitrification? Essentiellement par deux
phénomènes, qui peuvent agir simultanément: la baisse
du pH et celle du rH.
Toute forme chimique est en équilibre avec une ou plusieurs autres
et l'état de cet équilibre dépend de divers paramètres,
comme le pH. Si une forme devient plus stable qu'une autre quand le milieu
vient à évoluer, alors la concentration de celle-ci augmentera
au détriment de l'autre.
Ainsi, si le pH décroît, c'est-à-dire si le milieu
devient plus acide, la forme la plus stable chimiquement deviendra NH4+
(forme "acide"); de même, si le rH diminue (par exemple
si la D. B. O. augmente, donc si la consommation d'oxygène s'accroît,
ce qui entraine une diminution du pouvoir oxydant du milieu), la forme
la plus stable sera la moins oxydée donc NH4+.
En effet, les nitrates (NO3-) sont la forme la plus
oxydée de l'azote (3 atomes d'oxygène pour 1 d'azote) et
se forment donc dans un environnement non réducteur.
Les deux situations sont liées et si une très bonne aération
(oxygénation) en milieu marin favorise le maintien d'un pH élevé,
une surpopulation qui entraine donc une grande consommation d'oxygène
et la libération d'un important volume de dioxyde de carbone (acidifiant),
en milieu d'eau douce non tamponné, pourra faire chuter le pH jusqu'à
des valeurs alarmantes. Ceci illustre la synergie possible entre les deux
aspects et explique le fait déjà signalé, à
savoir que des organismes peuvent résister à des teneurs
élevées de nitrates si les conditions du milieu restent
favorables (pH et rH grands).
L'on comprend donc que, même si les nitrates demeurent peu toxiques,
leur accumulation pose des problèmes qui méritent que l'on
y prête attention.
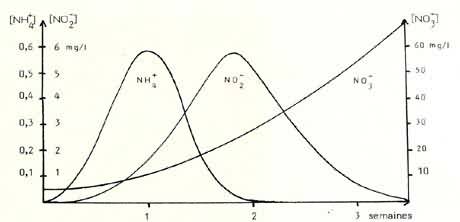 |
| Figure
3: Schématisation de l'établissement de la nitrification en aquarium. Au début, l'eau n'est supposée ne contenir que 5 mg/l de NO3- (eau du robinet par exemple). Dès l'introduction d'organismes, l'on constate une augmentation du taux d'ions ammonium (NH4+), consécutif à la dégradation bactérienne des matières azotées. Succèdent un accroissement de la teneur en nitrites (NO2-), d'où la diminution du taux d'ammonium, et enfin la baisse du taux des nitrites, ceux-ci étant oxydés à leur tour. Les nitrates, ultime étape de ce processus croissent alors régulièrement, les deux précédents stades n'apparaissant normalement plus. Il faut compter 34 semaines avant la stabilisation du phénomène, de sorte qu'à partir de ce moment, seuls les nitrates sont présents. Leur accumulation peut alors suivre plusieurs voies (cf. figure suivante). |
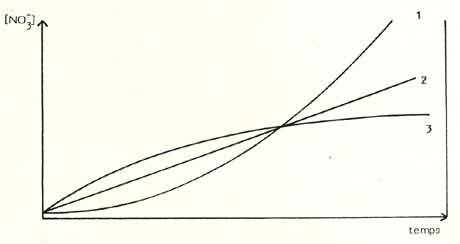 |
| Figure
4: Parmi celles-ci, nous pouvons distinguer: en 1: rapide eutrophisation par augmentation de la population de poissons ou d'invertébrés. en 2: milieu stable avec accumulation régulière de nitrates (population constante). en 3: milieu équilibré avec accumula tin modérée des déchets (siphonnages), changements d'eau fréquents, d'où la stabilisation vers une valeur que l'on peut calculer et qui ne sera pas dépassée. |
Il - Les moyens de surveillance et de lutte:
1 - Les méthodes de dosage:
La précision n'étant pas essentielle (peu importe qu'il
y ait 200 ou 300 mg/ I de nitrates), toutes les méthodes utilisées,
malgré les nombreuses limitations qui les caractérisent,
sont aux yeux de l'aquariophile aussi performantes, de sorte que seuls
les critères de simplicité et de coût interviendront
dans le choix de l'une d'elles.
Nous ne nous attarderons que sur celles qui nous le semble mériter.
- réduction par le diphénylaminesulfonate de sodium:
Un dérivé coloré en violet apparait. Le nombre de
réactifs limité, le matériel simple et réduit,
l'évaluation visuelle de la coloration qui permet de se passer
de spectromètre et sa rapidité (quelque 10 min), font autant
de raisons qui nous la font préférer.
L'on peut doser à 5 % près des solutions renfermant 0,1
à 5 mg/I de nitrates. L'aquariophile sera donc amener à
diluer préalablement l'eau de son bac, ceci de façon approximative,
bien sûr.
Le mode opératoire en est le suivant:
A 5 ml de solution, ajouter 50 mg de chlorure de potassium (KCI) et agiter
jusqu'à dissolution (rapide).
Ajouter alors 5 ml d'acide sulfurique concentré (H2SO4) et laisser
refroidir après avoir bien agité le mélange. ATTENTION!,
l'utilisation d'un tel acide est dangereuse.
Verser ensuite 50 bl d'une solution à 0,2 % de diphénylsulfonate
de sodium, celle-ci étant obtenue par dissolution (difficile) de
200 mg de réactif dans 100 ml d'eau pure.
Agiter et observer!
En présence d'air, la coloration s'intensifie peu à peu
jusqu'à ne plus permettre de voir une différence entre une
solution riche en nitrates et une solution qui en est dépourvue
(incolore au départ). Il convient alors de comparer la coloration
au bout d'un temps fixe et court, par exemple 20 s.
La suite peut s'effectuer de deux manières:
Soit l'on a préparé une solution à 5 mg/I de nitrate
de potassium (KNO3), qui contiendra 3 mg/I de nitrates, et
dont on se servira comme témoin; soit l'on se fixe une valeur arbitraire
de la dilution de l'eau de l'aquarium (par exemple 50, c'est-à-dire
1 ml dans 50 ml d'eau pure) et l'on estime, en fonction de l'intensité
de la teinte, si la teneur est trop élevée ou non. Prenons
deux exemples:
l'eau de l'aquarium est diluée 50 x. Parallèlement, l'on
prépare une solution à 3 mg/I de NO3-.
L'on effectue les deux dosages simultanément et la comparaison
des intensités est immédiate.
 |
| Photo: Un sol dont la composition a été bien étudiée, peut contribuer à stabiliser les qualités physico-chimiques d'une eau. |
Si la solution correspondant à l'aquarium est plus foncée,
son eau contient plus de 150 mg/I de NO3- ; si elle
est plus claire, elle en contient moins. Dans les deux cas, la différence
d'intensité est évidemment proportionnelle à la différence
de concentration. L'on a donc là un renseignement tout à
fait suffisant, d'autant qu'en modifiant la valeur de la dilution, chacun
pourra adapter la méthode à son idée (si l'on préfère
ne pas dépasser 30 mg/I, l'on diluera seulement 10 x, etc.).
l'on n'effectue la détermination que sur l'eau de l'aquarium diluée
50 x. Si la coloration est foncée, l'on en déduira que le
taux de nitrates est suffisamment élevé pour rendre nécessaire
un changement d'eau.
Ici aussi, l'on adaptera au besoin la dilution selon les limites que l'on
tient à respecter.
Cette méthode, très subjective, n'en demeure pas moins intéressante
et sa simplicité devrait inciter à l'essayer, sinon l'adopter.
N'oublions pas néanmoins les tests commerciaux prévus pour
ce dosage qui, de par leur simplicité, nous paraitrons assez sujet
à caution en ce qui concerne l'exactitude, mais dont l'aquariophile
peut à raison se contenter. A chacun d'apprécier si le critère
de rentabilité est vérifié, celui-ci étant
fonction du nombre de mesures que l'on compte effectuer.
Parmi ceux-ci, nous allons décrire les tests développés
par la firme Merck sous la dénomination Merckoquant®.
Originellement conçus pour l'analyse des eaux d'alimentation, industrielles
ou résiduaires, le contrôle des eaux de source, de rivières
ou de lacs, l'analyse des sols, la surveillance de la pollution atmosphérique
ou l'usage aquariophile, ils permettent le dosage semi-quantitatif des
ions selon une procédure simple et rapide.
Parmi les tests fabriqués, l'aquariophile en utilisera avec profit
quelques uns comme les tests ammonium, calcium, cuivre, fer, nitrites
et, bien sûr, nitrates.
Tous ces tests s'offrent sous une même présentation et s'utilisent
pareillement: une bandelette de matière plastique de quelques centimètres
carrés est imprégnée des réactifs adéquats
et des produits chimiques nécessaires pour assurer la sélectivité
et l'universalité de la mesure.
Après trempage dans la solution à analyser, il suffit de
comparer à une feuille sur laquelle ont été imprimées
les couleurs correspondant à des solutions de concentrations différentes
de l'ion dosé, la bandelette.
La conservation est très bonne et pourra atteindre quelques années
si les précautions habituelles sont respectées (chaleur
et humidité proscrites).
- le test nitrates:
La méthode se fonde sur la formation d'un composé coloré
en carmin qui est obtenu après réduction extemporanée
des nitrates en nitrites. Notons que l'une des extrêmités
de la bandelette n'est sensible qu'aux seuls nitrites (qui est un ion
interférant si sa concentration dépasse 0,5 mg/I, c'est-à-dire
qu'il conduira à des erreurs sur le résultat attendu), ce
qui permet de corriger la valeur obtenue par appréciation de leur
concentration. Cette possibilité est d'ailleur suffisamment utile
en elle-même pour inciter à acquérir ce test.
Hormis ce cas, les anions et les cations usuels ne provoquent pas d'interférence
aux concentrations habituelles.
Deux minutes après trempage, l'on peut comparer les couleurs et
estimer la teneur en nitrates avec une bonne précision pour nous.
En effet, les différentes teintes imprimées sont réparties
comme suit: 0 - 10 - 30 - 100 - 250 - 500 mg/I. Si l'on ajoute que la
valeur est indépendante du pH dans une vaste gamme (1 à
12!), l'on ne peut que juger cette méthode attrayante.
Il existe également des trousses d'analyse comportant plusieurs
tests, la méthode en étant plus classique (liquide à
ajouter à l'eau jusqu'à obtention d'une solution colorée).
Ces trousses, vendues par la même marque sous l'appellation Aquamerck,
permettent le dosage des ions ammonium, nitrite, du pH, des duretés
totale et carbonatée en plus du dosage des nitrates, qui lui, se
fait selon la méthode qui vient d'être décrite.
 |
| Premier type de végétaux en ce qui concerne l'élimination des nitrates, les plantes flottantes comme Salvinia ou Eichhornia, de par leur forte croissance et du fait qu'elles puisent directement les sels minéraux de l'eau, contribuent à baisser sensiblement la teneur en nitrates. Les nombreux autres avantages qu'elles procurent (protection, entretien d'une microfaune...) les rendent très recommandables. |
2 - La lutte:
Si, comme nous l'avons vu, l'accroissement du taux de nitrates est donc
normal en aquarium, l'on conçoit que pourront survenir de graves
problèmes, ce qui justifie l'objet du présent paragraphe.
La lutte peut intervenir à deux niveaux: éviter l'apparition
du phénomène en le retardant sans cesse ou intervenir lorsqu'il
se manifeste; mais c'est là un exercice de haute voltige au cours
duquel vos pensionnaires n'y réchapperont sans doute pas. ... La
première solution semble donc la seule viable.
Pour ce faire, il est utile de pouvoir apprécier la concentration
en nitrates, ce qui peut être tenté à l'aide des méthodes
décrites.
En ce qui concerne les eaux de distribution à usage alimentaire,
alors que l'O. M. S. (Organisation Mondiale pour la Santé) préconise
une teneur inférieure à 100 mg/I, les états membres
de la Communauté Européenne conseillent des valeurs de 25
mg/I et indiquent 50 mg/I comme limite supérieure.
L'accroissement de la teneur en nitrates dans les eaux souterraines des
pays développés, durant ces dernières années,
semble irréversible en l'état actuel, du fait de l'origine
de la pollution.
Sous prétexte de rendements incessamment meilleurs, les agriculteurs
usent et abusent d'engrais, et l'incidence économique en est telle
qu'il serait jugé déraisonnable de blâmer de telles
pratiques culturales.
Mais, nous l'avons précédemment vu, d'autres sources participent
également à ce phénomène, si bien que l'eau
de conduite, utilisée par la majorité d'entre nous, peut
donc renfermer des quantités notables de cet ion, ce qui ne peut
qu'accélérer le processus d'eutrophisation dont nous avons
parlé.
Si l'amélioration des pratiques agricoles et la baisse des rejets
industriels (agro-alimentaires notamment) et urbains n'est pas effective,
les stations d'épuration doivent donc tenter d'amoindrir cette
pollution.
Si toutes les techniques sont, a priori, utilisables pour celles-ci comme
pour nous, l'on conçoit que des divergences naîtront nécessairement,
les quantités d'eau traitée n'ayant rien de comparables.
C'est ici que l'aquariophile est quelque peu avantagé car le faible
volume à épurer autorise l'usage de techniques performantes,
donc coûteuses, qui demeurent de ce fait inutilisables à
grande échelle: je veux parler de l'ultrafiltration et de l'échange
d'ions.
En effet, parmi toutes les techniques utilisées pour purifier une
eau - oxydation ( par l'air, l'ozone, le chlore ...), filtration, mécanique
(tamisage, flottation, coagulation-floculation, décantation, ultrafiltration),
filtration biologique (nitrification et dénitrification), absorption
et échange d'ions (charbon actif, résines synthétiques,
zéolites) ou traitements chimiques (ajustement du pH) -, seules
permettent d'éliminer les nitrates les techniques de filtration
biologique (sélectivement) et d'échange d'ions ou d'osmose
inverse (non sélectivement).
Cependant, si la filtration biologique (dénitrification) est à
réserver aux stations d'épuration (l'aquariophile demande
exactement le contraire à ses filtres!), le traitement par les
deux autres techniques est irréalisable à ce niveau.
En France, notons d'ailleurs que seuls les procédés de dénitrification
biologique sont agréés par les instances administratives;
la chaîne de traitement comporte alors un réacteur biologique
où les bactéries dénitrifiantes, fixées sur
un support poreux au travers duquel circule l'eau à traiter, transforment
les nitrates en diazote (cf. le cycle de l'azote).
Insistons également sur le fait, et ceci concerne la nitrification
(filtration biologique des aquariums) comme la dénitrification,
que la vitesse de passage de l'eau à travers le matériau
(roche concassée, sable, charbon actif, mousse synthétique
. . .) doit être très faible, de l'ordre de quelques mètres
par jour ou par heure, ce qui justifie pleinement l'emploi de pompes peu
puissantes. Si la vitesse est élevée, la filtration devient
alors essentiellement mécanique (rétention des particules).
En fait, la filtration biologique existe néanmoins en aquarium
puisque chacun sait que les végétaux utilisent les nitrates
pour croître (d'où leur présence dans les engrais);
mais il ne s'agit pas là de bactéries.
 |
| Photo: Lemna, Salvinia, Ceratophyllum et Myriophyllum dans l'eau polluée du Dal Lake (Cachemire) |
Suite à tout ce qui a été dit précédemment,
l'on arrivera à contrer le phénomène d'eutrophisation
en retirant les déchets non dégradés et/ou en éliminant
leurs produits de dégradation. Dans les deux cas, il s'agira de
rompre le cycle de l'azote afin d'éviter, l'accumulation de nitrates.
Si leur élimination sélective n'est pas possible, l'élimination
non sélective, c'est-à-dire accompagnée de l'élimination,
d'autres composés, est réalisable. Elle fera appel à
diverses techniques telles l'osmose ou l'échange d'ions sur résines
synthétiques.
- l'osmose inverse:
Rappelons que la pression osmotique est la force qui s'exerce sur une
membrane hémiperméable (perméable à l'eau
seulement) séparant deux solutions de concentrations différentes.
Elle fait passer l'eau de la solution la moins concentrée (hypotonique)
vers la solution la plus concentrée (hypertonique) jusqu'à
ce que l'équilibre soit atteint (isotonie).
L'on imagine alors, et c'est là le principe de l'osmose inverse,
qu'une pression contraire à la pression osmotique (d'où
le nom) oblige l'eau du milieu hypertonique à traverser la membrane,
ce qui permet donc de recueillir de l'eau très pure, les matières
en solutions étant arrêtées.
Cette technique, dont le schéma de principe permettant de la comparer
à d'autres méthodes de filtration est fourni, n'est que
très peu utilisée mais semble promise à un brillant
avenir, même si l'aquariophilie n'interviendra que peu dans son
développement.
- l'échange d'ions:
Au contraire de la technique précedente qui est purement physique
et doit à ce titre être comparée aux techniques analogues
(dialyse, ultrafiltration), l'échange d'ions est un processus chimique
consistant en l'échange réversible d'ions entre une phase
solide (résine) et une phase liquide (eau).
Les ions dissous dans l'eau peuvent être fixés sur la résine,
celle-ci en libérant d'autres qui occupaient les sites. Leur affinité
diffère selon leur charge électrique, leur taille et la
nature de la résine (voir ci-dessous). De plus, pour un même
ion, la capacité de fixation dépend du pH, de la température,
de la force ionique (l'eau douce a une faible force ionique, l'eau de
mer une importante) et de la concentration de cet ion dans l'eau.
Après saturation de la résine, c'est-à-dire lorsque
tous les sites sont occupés, celle-ci doit être régénérée
si l'on souhaite sa réutilisation. Pour ce faire, il suffit de
faire passer une solution contenant un ion d'affinité supérieure
à celle de l'ion adsorbé (échange inverse en quelque
sorte).
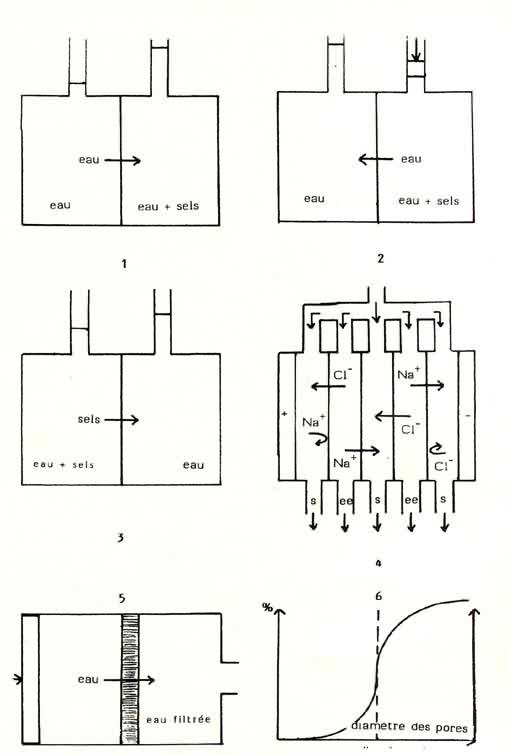 |
| Comparaison
des méthodes de filtration mécanique de hautes performances: 1 - osmose directe: l'eau passe de la solution la moins concentrée vers la solution la plus concentrée. 2 - osmose inverse: sous l'action d'une pression contraire à la pression osmotique, l'eau passe du milieu le plus concentré vers le milieu le moins concentré. 3 - dialyse: les sels minéraux vont vers la solution la plus diluée. 4 - électro-dialyse: sous l'action d'un champ électrique, les ions vont migrer (les cations vers la cathode, les anions vers l'anode) et, du fait de la perméabilité sélective des membranes, sont ou non piégés dans un compartiment. L'on a donc alternativement des compartiments d'eau épurée et d'eau enrichie en sels (saumure). 5- ultrafiltration: l'on force l'eau à traverser une membrane poreuse. Suivant le diamètre des pores, dont la répartition est schématisée en 6, l'on peut atteindre divers seuils de filtration. |
Ainsi, l'on pourra retenir les ions NO3- sur une
résine anionique forte, ce qui libérera des ions OH-,
et la régénération s'effectuera par élution
avec une solution de soude (NaOH), les ions OH-, en forte concentration,
réintégrant leur place première.
Cette technique peut être comparé (mais non confondue!) à
l'adoucissement de l'eau, processus au cours duquel les ions calcium et
magnésium seront remplacés par des ions sodium. L'on obtient
de la sorte une eau décarbonatée, dont la dureté
temporaire est donc nulle, mais parfaitement artficielle puisque la salinité
est inchangée. L'eau est alors impropre à l'usage aquariophile.
Les résines doivent être insolubles dans l'eau, posséder
une grande capacité d'échange, présenter une structure
poreuse permettant la diffusion des ions, être chimiquement inertes
et mécaniquement résistantes afin de limiter leur attrition.
Leur structure consiste en des macromolécules constituées
de polymères d'hydrocarbures sur lesquels sont greffés des
ions. C'est ceux-ci qui s'échangeront avec ceux présents
dans l'eau.
Elles se présentent sous forme de petites billes d'environ 1 mm
de diamètre.
On distingue, suivant les ions qui y sont greffés, les résines
anioniques des résines cationiques:
- les résines cationiques fortes:
Elles échangent tous les cations suivant la réaction: RS03-
H+ + NaCI <=> RS03-Na+
+ HCI
L'on voit donc qu'il y a permutation entre le cation présent dans
l'eau et l'ion H+ fixé sur la résine (symbolisée
RSO3H), de sorte que l'on obtient une eau acidifiée.
La réaction se poursuivra tant que la totalité des sites
ne sera pas utilisée. Avec ce type de résine, tous les cations
(calcium, sodium, magnésium, potassium . ..) seront éliminés
de l'eau.
les résines cationiques faibles:
De structure RCOOH, elles ne peuvent fixer que les cations forts et l'on
obtient une eau légèrement acide.
- les résines anioniques fortes:
Elles échangent tous les anions selon:
RN+OH- + KNO3 RN+NO3- + KOH
L'eau traitée sera donc basique et l'on remarque que l'utilisation
d'une telle résine avec une résine cationique forte conduit
à l'obtention d'une eau totalement déminéralisée,
ni acide, ni basique.
En effet, prenons l'exemple d'une eau renfermant du sel (NaCI): résine
cationique forte: RS03-H+ + Na+Cl-
<=> RS03-Na+ + H+Cl- résine anionique
forte: RN+01-1- + H+Cl- RN+Cl-
+ H+OH- soit le bilan: (RSO3H + RNOH) résine
+ NaCI eau <=> (RSO3Na + RNCI) résine + H20
C'est ce procédé, sous forme de lits mélangés
(les deux types de résines sont dans la même colonne) ou
de lits séparés (les résines sont chacune dans une
colonne différente, ce qui facilite la régénération),
qui est universellement utilisé pour désioniser une eau.
- les résines anioniques faibles:
Ne seront éliminés que les anions forts et l'eau obtenue
sera légèrement basique.
Comme la technique de l'osmose inverse, l'échange d'ions n'est
pas sélectif et seront fixés sur la résine les ions
chlorues, sulfates, etc., comme les ions nitrates.
La méthode la plus commode est universellement connue et pratiquée:
le changement d'eau. Dans ce cas, il s'agit d'un abaissement de la concentration
par dilution. Cette méthode est très aisée, non traumatisante
pour les êtres vivants si elle est modérée, tout en
étant efficace pour peu qu'elle soit régulière.
Chaque fois que l'on va changer une partie de l'eau, l'on va remplacer
un certain volume d'eau chargée en matières organiques et
en nitrates par le même volume d'eau non polluée.
Plus les changements seront importants en quantité et plus la baisse
de concentration des polluants sera forte. Cependant, toute brusque variation
est préjudiciable à la faune et à la flore, tant
et si bien qu'il sera préférable de changer peu d'eau à
la fois. Afin de compenser cette moindre action, il suffira seulement
de le faire plus souvent. La baisse sera ainsi chaque fois faible mais
elle interviendra régulièrement et sera donc tout aussi
efficace. Pour faire image, c'est un peu comme si nous descendions un
escalier comprenant beaucoup de petites marches au lieu de quelques
grosses; la première solution est la moins fatigante! A la limite,
l'on aura une pente continue, ce qui permettra même aux bébés
de suivre ce chemin . . . N'est-ce pas là le principe du goutte
à goutte ? Donc, changeons l'eau ! Changeons l'eau, oui !, mais
peu et souvent !
 |
| Photo
du haut: Généralement, tous les cyprinidés sont
d'ailleurs salissants, comme par exemple le Barbus Barbus pentazona.
Très résistants, ils sont cependant facile à
garder. Photo du bas: Les poissons peu salissants sont parfois malheureusement fragiles, comme les Tétras, ici Hyphessobrycon serpae. |
La seconde option consiste à éliminer les matières
organiques avant dégradation. Les avantages sont identiques et
l'on ne peut que la recommander. Ceci sera obtenu en ôtant les déchets
au moyen d'un aspirateur ou en enlevant une partie des métabolites
(protéines) grâce à un écumeur.
Ce n'est alors pas des nitrates que l'on enlèvera mais des molécules
qui normalement se dégraderaient en en générant.
L'on intervient donc à un niveau situé plus en amont. Pour
en revenir à notre bâtisse, c'est comme si nous diminuions
la hauteur entre les deux étages ; l'action sera bénéfique,
quel que soit l'escalier envisagé.
D'autre part, concomitamment à ces mesures à la fois préventives
et curatives (changements d'eau), l'on veillera à ne pas trop nourrir
les poissons, ne pas surpeupler son bac et à le planter correctement,
autant que faire se peut.
Il ne s'agit là que d'éviter l'apport trop important de
matières azotées (nourriture des poissons), en intervenant
donc directement à la source, ou d'accélérer leur
assirrilation (par les végétaux), intervention ultime.
Pour clore ce paragraphe, récapitulons les facteurs propices à
cette lutte:
- faible population animale,
- faibles apports de nourriture,
- importante population végétale,
- bonne qualité du milieu (éclairage, oxygénation),
- siphonnages des déchets fréquents,
- écumage obligatoire en eau de mer,
- nettoyage régulier du filtre,
- changements d'eau fréquents.
De cette façon, seront évités les désagréments
que peuvent occasionner les nitrates en concentration trop élevée.
III - Conclusion:
Aux rares aquariophiles habitués aux manipulations de laboratoire
et pour qui l'approvisionnement en réactifs et matériel
ne pose guère de problème, une méthode semble à
conseiller: la réaction avec le diphénylamine sulfonate
de sodium.
Pour la majorité d'entre nous, les tests prévus à
cet effet paraissent indubitablement beaucoup plus appropriés,
même si leur prix relativement élevé, qui s'explique
par les difficultés inhérentes à ce dosage, reste
dissuasif.
Quoiqu'il en soit, le respect de quelques principes et l'application de
certaines pratiques prophylactiques permettront de se prémunir
contre l'accumulation trop importante des nitrates et de la sorte, réduiront
considérablement l'intérêt d'un contrôle de
leur concentration.
A ce titre, cette démarche, dans la mesure où elle s'inscrit
dans un courant de pensée en faveur de l'écologie, nous
semble la plus adéquate pour lutter contre ce délicat problème.
Malgré l'apparent paradoxe, les changements d'eau réguliers
sont à l'heure actuelle le meilleur moyen permettant le maintien
d'un milieu stable et (artificiellement) équilibré, rendant
l'analyse superflue, d'autant qu'elle s'avère délicate.
| Quelques
explications ... D.B.O.: Il s'agit de la consommation d'oxygène correspondant à la dégradation de la matière organique. Une faible D.B.O. peut correspondre à un milieu biologiquement défavorable. ION: Atome ou groupe d'atomes portant une charge électrique. Ils sont donc attirés par une charge de signe opposé (le terme vient du nom d'un roi mystique du Péloponnèse qui symbolisait une vie d'errance). Dans l'eau, ils résultent généralement de la dissociation des sels: sel <=> cation + anion NaCI <=> Na+ CI- rH: Quantité analogue au pH mais qui se rapporte à H2 et non à H+. Le rH caractérise l'aptitude d'un milieu à être réduit ou oxydé. Si le rH est petit (0 à 27), le milieu est réducteur, d'où la possible formation de méthane, hydrogène sulfuré ou réduction des nitrates .. . Sinon (27 à 54), il est oxydant et donc favorable à la vie évoluée. |
